Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Možganska kap pod mikroskopom
članki
eSinapsa, 2011-1
Zvezdan Pirtošek
Eksoskeleti – inteligentne bionske naprave
Marko Munih
O aktualnih dilemah draženja globokih možganskih struktur pri obsesivno - kompulzivni motnji
Nadja Jarc
Sledite svojo srečo ... z iPhone
Urban Kordeš
eSinapsa, 2011-2
Renata Salecl
Gašper Tkačik
Astrociti – spregledane zvezde nevrobiologije
Marko Kreft, Robert Zorec
Sašo Dolenc
Meditacija - malo truda, veliko koristi
Luka Dimic
eSinapsa, 2011-3
Mara Bresjanac
Martina Starc
Rok Berlot
Varnost uporabe generičnih protiepileptičnih zdravil
Mojca Kržan, Matevž Kržan
Možgani, računalniki - nekaj vmes
Miha Pelko
eSinapsa, 2012-4
Ali so moški in ženski možgani različni?
Gregor Majdič
O kognitivnih motnjah pri bolnikih s Parkinsonovo boleznijo
Dejan Georgiev
Akutno možgansko kap lahko uspešno zdravimo
Nina Vujasinovič, Bojana Žvan
Vloga nevropsihološke diagnostike pri odkrivanju zgodnjih znakov alzheimerjeve bolezni
Simon Brezovar
eSinapsa, 2013-5
Subarahnoidna krvavitev zaradi tromboze venskih sinusov
Mateja Repar, Anita Resman Gašperčič
Srečanje dveh velikanov: možganov in imunskega sistema
Matej Markota
Novo odkritje na področju sporadičnih prionskih bolezni
Jana Jerše, Nadja Jarc
Učinek placeba brez lažnih zdravil in zavajanja
Mara Bresjanac
eSinapsa, 2013-6
Odstranjevanje možganskih tumorjev pri budnem bolniku
Andrej Vranič, Jasmina Markovič, Blaž Koritnik
Zmedena bolnica, ki nič ne vidi ali PRES
Manja Hribar, Vid Zgonc
Manja Hribar
Sistemska skleroza in ishemična možganska kap - vzročna povezanost ali le koincidenca?
Mateja Repar, Janja Pretnar Oblak
Netravmatska lokalizirana konveksitetna subarahnoidna krvavitev
Mateja Repar, Fajko F. Bajrović
Klemen Grabljevec
Z omejevanjem spodbujajoča terapija pri bolnikih po nezgodni možganski poškodbi
Dejana Zajc, Klemen Grabljevec
eSinapsa, 2014-7
Možgani v mreži navezanosti, ki nas zaznamuje
Barbara Horvat
Vpliv senzoričnega dotoka na uglasitev možganskih povezav
Peter Gradišnik
Človeški konektom ali kakšne so zveze v naših možganih
Blaž Koritnik
Niko Lah
Torkove delavnice za osnovnošolce
Mateja Drolec Novak, Vid V. Vodušek
Da ne pozabim! Tehnike za pomladitev spomina
Klara Tostovršnik, Hana Hawlina
Površina socialne nevroznanosti
Manuel Kuran
Clarity - bistri možgani Karla Deisserotha
Gregor Belušič
Barbara Gnidovec Stražišar
Bojana Žvan
Nevroplastičnost po možganski kapi
Marjan Zaletel
Klinično psihološka obravnava pacientov po možganski kapi in podpora pri vračanju na delovno mesto
Barbara Starovasnik Žagavec
Možgani: organ, s katerim ljubimo
Andraž Matkovič
Marija Šoštarič Podlesnik
Gibalno-kognitivna vadba: praktična delavnica
Mitja Gerževič, Marina Dobnik
Anton Grad
Nevrologija, imunologija, psihiatrija …
Bojan Rojc
Andraž Stožer, Janez Bregant
Dominika Novak Pihler
Možganska kap – »kako ostati v omrežju?«
Nina Ozimic
Klara Tostovršnik
eSinapsa, 2014-8
Znotrajžilno zdravljenje možganskih anevrizem
Tamara Gorjanc, Dimitrij Lovrič
Obravnava hladnih možganskih anevrizem
Bojana Žvan, Janja Pretnar Oblak
Ali deklice z Rettovim sindromom govorijo z očmi?
Anka Slana, Urška Slana
Progresivna multifokalna encefalopatija
Urša Zabret, Katarina Šurlan Popovič
Ne ubijaj – poskusi na živalih
Martina Perše
Poizkusi na živalih - za in proti
Simon Horvat
eSinapsa, 2015-9
Kako deluje navigacijski sistem v naših možganih
Simon Brezovar
Vsakodnevno delo slepe osebe / s slepo osebo
Denis Kamnar
Uroš Marušič
Manca Tekavčič Pompe
Toni Pustovrh
Marko Hawlina
Od svetlobe do podobe ali kako vidijo svet naši možgani
Simon Brezovar
Janja Hrastovšek
Zala Kurinčič
Pogledi na mejno osebnostno motnjo
Jerica Radež, Peter Kapš
Uvid kot socialno psihološki fenomen
Vid Vodušek
Uvod v vidno-prostorske funkcije s praktičnimi primeri
Ana Bujišić, Sanja Roškar
eSinapsa, 2015-10
Difuzijsko magnetnoresonančno slikanje
Rok Berlot
Katja Pavšič
Radiološko izolirani sindrom - ali ga moramo poznati?
Matej Vouk, Katarina Šurlan Popovič
Kako izgledajo možgani, ki govorijo več jezikov?
Gašper Zupan
Nov pristop v rehabilitaciji - terapija s pomočjo psa
Mateja Drljepan
Pogled v maternico z magnetnoresonančno preiskavo
Taja Jordan, Tina Vipotnik Vesnaver
Saša Zorjan
Saša Zorjan
Nevroestetika: ko nevroznanost obišče galerijo
Anja Voljavec, Hana Hawlina, Nika Vrabič
Ali so psihogeni neepileptični napadi res psihogeni?
Saška Vipotnik, Gal Granda
Kako nam lahko glasna glasba »vzame« sluh in povzroči tinitus
Nejc Steiner, Saba Battelino
eSinapsa, 2016-11
Mara Bresjanac
Kako ultrazvok odpira pot v možgane
Kaja Kolmančič
Kako je epigenetika spremenila nevroznanost
Metka Ravnik Glavač
Ondinino prekletstvo ali sindrom prirojene centralne hipoventilacije
Katja Pavšič, Barbara Gnidovec Stražišar, Janja Pretnar Oblak, Fajko F. Bajrović
Zika virus in magnetnoresonančna diagnostika nepravilnosti osrednjega živčevja pri plodu
Rok Banko, Tina Vipotnik Vesnaver
Motnje ravnotežja otrok in odraslih
Nejc Steiner, Saba Battelino
eSinapsa, 2016-12
Vloga magnetnoresonančne spektroskopije pri obravnavi možganskih tumorjev
Gašper Zupan, Katarina Šurlan Popovič
Tiskanje tridimenzionalnih modelov v medicini
Andrej Vovk
Aleš Oblak
Kevin Klarič
Sinestezija: umetnica, ki ne želi odrasti
Tisa Frelih
Računska psihiatrija: od nevroznanosti do klinike
Nastja Tomat
Kognitivni nadzor: od vsakdanjega življenja do bolezni
Vida Ana Politakis
eSinapsa, 2017-13
Internet: nadgradnja ali nadomestek uma?
Matej Perovnik
Vloga črevesnega mikrobioma pri odzivu na stres
Vesna van Midden
Stres pušča posledice tako na človeškem kot živalskem organizmu
Jasmina Kerčmar
Prikaz normalne anatomije in bolezenskih stanj obraznega živca z magnetno resonanco
Rok Banko, Matej Vrabec
Psihedelična izkušnja in njen zdravilni potencial
Anja Cehnar, Jona Basle
Vpliv hiperglikemije na delovanje možganov
Jasna Šuput Omladič, Simona Klemenčič
Nevrofibromatoza: napredujoče obolenje centralnega in perifernega živčevja
Nejc Steiner, Saba Battelino
Fenomen žrtvenega jagnja v dobi interneta
Dolores Trol
Tesnoba staršev in strategije spoprijemanja, ko pri otroku na novo odkrijejo epilepsijo
Daša Kocjančič, Petra Lešnik Musek, Vesna Krkoč, David Gosar
eSinapsa, 2017-14
Zakaj ne zapeljem s ceste, ko kihnem?
Anka Slana Ozimič, Grega Repovš
Nobelova nagrada za odkritje molekularnih mehanizmov nadzora cirkadianih ritmov
Leja Dolenc Grošelj
Možgani pod stresom: od celic do duševnih motenj
Nastja Tomat
Na sledi prvi vzročni terapiji Huntingtonove bolezni
Danaja Metul
Razlike med spoloma pri Parkinsonovi bolezni
Kaja Kolmančič
eSinapsa, 2018-15
Susceptibilno poudarjeno magnetnoresonančno slikanje pri bolniku z ALS
Alja Vičič, Jernej Avsenik, Rok Berlot
Sara Fabjan
Reverzibilni cerebralni vazokonstrikcijski sindrom – pot do diagnoze
Maja Cimperšek, Katarina Šurlan Popovič
Liam Korošec Hudnik
Kognitivno funkcioniranje pri izgorelosti
Marina Horvat
eSinapsa, 2019-16
Maša Čater
Saša Koprivec
Infekcije osrednjega živčnega sistema s flavivirusi
Maja Potokar
Raziskava: Kako depresija vpliva na kognitivne sposobnosti?
Vida Ana Politakis
Razvoj depresije pri otrocih z vidika navezovalnega vedenja
Neža Grgurevič
Sonja Prpar Mihevc
Umetno inteligentna nevroznanost: srečanje nevronskih mrež in možganske fiziologije
Kristijan Armeni
Čebelji strup pri preventivi nevrodegenerativnih bolezni in priložnost za klinično prakso
Matjaž Deželak
eSinapsa, 2019-17
IgG4+ – skupni imenovalec diagnoz iz preteklosti
Cene Jerele, Katarina Šurlan Popovič
Nov molekulski mehanizem delovanja ketamina v astrocitih
Matjaž Stenovec
Praktični pristop k obravnavi utrujenosti in motenj spanja pri bolnikih z multiplo sklerozo
Nik Krajnc, Leja Dolenc Grošelj
Jure Pešak
eSinapsa, 2020-18
Bolezni spektra anti-MOG pri odraslih
Nik Krajnc
Samomor pod lupo nevroznanosti
Alina Holnthaner
eSinapsa, 2020-19
Ob mednarodnem dnevu znakovnih jezikov
Anka Slana Ozimič
Teorija obetov: kako sprejemamo tvegane odločitve
Nastja Tomat
Sara Fabjan
Matjaž Deželak
Nina Stanojević, Uroš Kovačič
Od človeških nevronov do možganskih organoidov – nova obzorja v nevroznanosti
Vesna M. van Midden
Splošna umetna inteligenca ali statistične jezikovne papige?
Kristijan Armeni
Zunajcelični vezikli kot prenašalci zdravilnih učinkovin preko krvno-možganske prepreke
Saša Koprivec
Matjaž Deželak
eSinapsa, 2021-20
Migrena: starodavna bolezen, sodobni pristopi k zdravljenju
Eva Koban, Lina Savšek
Zgodnji razvoj socialnega vedenja
Vesna Jug
Nastja Tomat
Mikrosplet: povezovanje preko mikrobioma
Tina Tinkara Peternelj
Stimulacija možganov kot način zdravljenja depresije
Saša Kocijančič Azzaoui
eSinapsa, 2021-21
eSinapsa, 2022-22
Sodobni vidiki motenj hranjenja
Karin Sernec
Ples in gibalni dialog z malčki
Neva Kralj
Atul Gawande
Jezikovna funkcija pri Alzheimerjevi bolezni
Gašper Tonin
Dostava terapevtikov preko krvno-možganske pregrade
Matjaž Deželak
eSinapsa, 2022-23
Akutni ishemični infarkt hrbtenjače pri zdravih otrocih – kaj lahko pove radiolog?
Katarina Šurlan Popovič, Barbara Šijaković
eSinapsa, 2023-24
Možganska omrežja pri nevrodegenerativnih boleznih
Tomaž Rus, Matej Perovnik
Morske živali kot navdih za nevroznanstvenike: morski konjiček, morski zajček in klobučnjak
Tina Bregant
Metoda Feldenkrais: gibanje in nevroplastičnost
Mateja Pate
Etično naravnana animalna nevroznanost
Maša Čater
Helena Motaln, Boris Rogelj
eSinapsa, 2023-25
Urban Košak, Damijan Knez, Anže Meden, Simon Žakelj, Jurij Trontelj, Jure Stojan, Maja Zakošek Pipan, Kinga Sałat idr.
eSinapsa, 2024-26
Naravno okolje kot vir zdravja in blagostanja
Karin Križman, Grega Repovš, Gaja Zager Kocjan, Gregor Geršak
Katja Peganc Nunčič, Damjan Osredkar
Tanja Goltnik
Ali je zgodnje vstajanje dedno?
Cene Skubic, Laura Plavc, Damjana Rozman, Leja Dolenc Grošelj
eSinapsa, 2024-27
Širša terapevtska uporaba ketamina: potenciali in izzivi
Kristian Elersič
Moč vpliva socialne opore na bolečino
Jana Verdnik
Benjamin Bušelič
Urška Černe, Anemari Horvat, Robert Zorec, Nina Vardjan
eSinapsa, 2025-28
Maša Čater, Nastja Blagovič, Urška Jerič, Agata Kokalj Malovrh, Nuša Balen, Tanja Kunej
Vpliv izobrazbe na skrb za zdravje možganov
Hana Kos, Matej Perovnik
Selena Horvat, Anja Pišlar
Možganska kap je v svetovnem merilu drugi največji vzrok smrti in glavni dejavnik invalidnosti, njena incidenca v razvitem svetu pa narašča. Ob svetovnem dnevu možganske kapi, ki ga obeležujemo 29. oktobra vsako leto, je primerno, da naredimo pregled najnovejših ugotovitev. Glede na vzročnost delimo možgansko kap na dve glavni skupini: hemoragično možgansko kap, do katere privede počena krvna žila v možganih s posledično krvavitvijo, ter ishemična možganska kap, ki jo povzroči zamašitev možganske ali hrbtenjačne žile (praviloma arterije) s krvnim strdkom. Slednja predstavlja več kot 70% vseh primerov 1, zato se bomo v tem prispevku posvetili predvsem njeni obravnavi. Predstavili bomo najnovejša spoznanja na področjih epidemiologije, diagnostike, pristopih zdravljenja oz. obvladovanja posledic možganske kapi ter celične in molekularne biologije, ki spremljajo možgansko kap.
Epidemologija
Hemoragična in ishemična možganska kap skupaj na letni ravni v svetovnem merilu prizadeneta 13,7 milijona ljudi, od katerih jih 5,5 milijona umre 2. Incidenca in smrtnost sta se od leta 1900 do 2010 v razvitih državah zmanjšali, medtem ko v nerazvitih državah in v državah v razvoju ni bilo signifikantne spremembe 3.
Dejavnike tveganja lahko ločimo na nespremenljive, na katere ne moremo vplivati, in na spremenljive, ki so odvisni od našega načina življenja. Nespremenljivi dejavniki tveganja so starost, spol in nekatere genetske predispozicije, pri čemer višja starost in moški spol predstavljata večje tveganje za možgansko kap. Dednost ishemične možganske kapi je okrog 38%, pri čemer sta znani le dve monogenski predispoziciji, CADASIL (angl. Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leukoencephalopathy) in CARASIL (angl. Cerebral Autosomal Recesive Arteriopathy with Subcortical Infarcts and Leukoencephalopathy), sicer pa je večina primerov sporadičnih 4. Spremenljive dejavnike tveganja posameznik lahko kontrolira. Izmed teh jih je 10 takih, ki skupaj predstavljajo kar 91,5% populacijske vzročnosti: hipertenzija (največji dejavnik tveganja, 45,2% vzročnosti), nizka stopnja redne telesne aktivnosti, holesterol (visoko razmerje LDL/HDL), nezdrava in enolična prehrana, visoko razmerje med obsegom pasu in bokov, psihosocialni stres in depresija, kajenje, težave s srcem, prekomerno uživanje alkoholnih pijač ter sladkorna bolezen 5. Tekom življenja možganska kap prizadene 1 od 4 ljudi, 80 milijonov ljudi pa si od tega obolenja zadovoljivo opomore 6, vendar ti predstavljajo skupino z največjim tveganjem za ponovni pojav, zato so intenzivno vključeni v programe t. i. sekundarne preventive, ki so usmerjeni predvsem v odpravljanje spremenljivih dejavnikov tveganja.
Diagnostika
Klinična. V preteklosti je bila diagnostika možganske kapi izključno klinična, podana s strani izkušenega specialista nevrologije. Osnova za klinično diagnozo je t. i. osrednja nevrološka prizadetost (angl. Focal Neurologic Deficit), ki izhaja iz predpostavke, da se okvara specifičnega dela možganov kaže v motenem delovanju specifičnega dela telesa, to motnjo pa lahko klinično ustrezno opredelimo kot simptom možganske kapi. Najpogostejši simptomi so hemipareza (omrtvelost okončine), hemiplegija (paraliza okončine), hemianastezija (neobčutljivost polovice telesa), afazija (govorna oz. jezikovna prizadetost), homonomna hemianopsija (izguba vida iste polovice vidnega polja pri obeh očesih) in hemiprostorska nepozornost (nezmožnost zaznave dražljajev s polovico telesa). Simptomatika možganske kapi je sicer pogosto nespecifična, saj je lahko podobna simptomatiki migrene, epilepsije in drugih motenj (vestibularnih, metabolnih, funkcionalnih). S klinično diagnostiko tudi ne moremo ločiti med hemoragično in ishemično možgansko kapjo. Klinična slika je še danes edini temelj diagnoze v državah, kjer so zdravstvene ustanove slabše opremljene. V razvitejših predelih sveta jo dopolnjujejo bolj specifični pristopi, katerih predpogoj je sodobna elektronska in računalniška opremljenost 7.
Slikovna. S tehničnim razvojem medicinskih aparatur, konkretno naprav za dvo- in tridimenzionalno vizualizacijo (»slikanje«) notranjosti človeškega telesa so se možnosti za natančno diagnostiko možganske kapi bistveno izboljšale. V svetovnem merilu se najpogosteje uporablja računalniška tomografija (angl. Computer Tomography, CT), ki se lahko izvaja v nekontrastni in perfuzijski obliki. Prva ima 100-odstotno občutljivost za diagnozo hemoragične možganske kapi, druga, imenovana tudi CT-angiografija, pa se uporablja za diagnozo ishemične možganske kapi 8. Razlika med njima je, da se pri CT-angiografiji v krvni obtok vbrizga radiokontrastno sredstvo, običajno raztopina joda, s katerim dobimo uvid v mesto zamašitve možganske arterije in posledično prizadetega predela možganov (slika 1). V primerjavi s CT nudi slikanje z magnetno resonanco (angl. Magnetic Resonance Imaging, MRI) občutljivejšo in bolj informativno diagnostiko. Tudi pri MRI obstaja več izvedb, od katerih so najpogostejše difuzijska MRI, ki zaznava naključno gibanje vodnih molekul v tkivih, perfuzijska MRI, pri kateri je krvožilno kontrastno sredstvo raztopina gadolinijevih soli ter T2 MRI, ki temelji na merjenju časa spin-spin relaksacije vodikovih atomov v prečni smeri glede na magnetno polje 9.
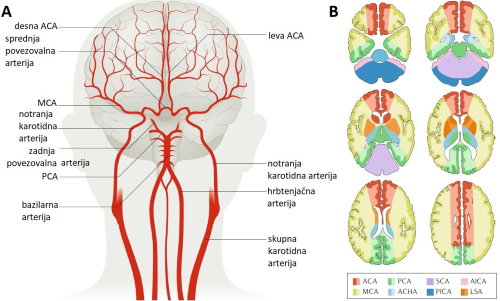
Slika 1: (A) Glavne možganske arterije in (B) njihovi predeli prekrvavitve možganov, shematsko prikazani kot horizontalne plasti. Možganska kap v eni od možganskih arterij povzroči okvaro v možganskem področju, ustrezno obarvanem na shemi razdelka B. ACA – sprednja možganska arterija, PCA – zadnja možganska arterija, SCA – zgornja arterija malih možganov, AICA – sprednja spodnja možganska arterija, MCA – srednja možganska arterija, AHCA – sprednja očesna arterija, PICA – zadnja spodnja arterija malih možganov, LSA – lentikulostriatna arterija. (Prirejeno po 7).
Biokemijska. Slikanje z metodama CT in MRI zahteva relativno drago opremo in visoko usposobljen medicinski kader, zato v manj razvitih državah navadno nista na voljo. Kot dopolnitev klinični diagnostiki se zato intenzivno iščejo krvni biološki označevalci, ki bi z enostavno analizo krvi hitro dali informacijo o tipu in poteku možganske kapi. Da je biološki označevalec uporaben v praksi, mora seveda biti ali občutljiv (z njim izločimo posamezno spremenljivko) ali specifičen (z njim potrdimo določeno spremenljivko), idealno pa je seveda, da je oboje hkrati. V zadnjih 20 letih je bilo opravljenih veliko tovrstnih študij, njihove ugotovitve pa je združila nedavna metaanaliza 10. Vključili so 40 najbolj verodostojnih študij, objavljenih od leta 1991 do 2020, in izmed 25 bioloških označevalcev identificirali 4 krvne proteine, ki kažejo diagnostični potencial. Možganski natriuretični peptid (hormon, ki pospešuje izločanje natrija), matriksna metaloproteinaza-9 (proteinaza, ki cepi gelatin in kolagen) in D-dimer (razpadni produkt fibrina) statistično značilno razlikujejo ishemično možgansko kap od hemoragične, od stanj, podobnih možganski kapi, in od zdravih posameznikov, medtem ko je glialni fibrilarni kisli protein (vloga pri mitozi astrocitov) različno izražen pri ishemični in hemoragični kapi.
Umetna inteligenca. Umetna inteligenca (angl. Artificial Inteligence, AI) kot taka ni diagnostični pristop, ampak se uporablja pri interpretaciji velike količine kliničnih, genetskih, imunoloških in slikovnih podatkov, ki jih tudi izkušen specialist težko poveže v celoto oz. izlušči uporabno vrednost 11. S pomočjo AI je veliko lažje postaviti diagnozo ter predvideti prognozo in najustreznejše zdravljenje za vsakega bolnika posebej, kar je glavni princip personalizirane medicine. Uporabnost AI za konkreten namen je odvisna od izbranega računskega algoritma, bistvene pa so čim večje in dobro karakterizirane podatkovne zbirke. V tem pogledu je že prišlo do mednarodnega sodelovanja in ideje o skupni svetovni bazi podatkov za personalizirano medicino možganske kapi (angl. Million Brains Initiative) 12.
Zdravljenje oz. obvladovanje posledic
Ko nastopi možganska kap, je najpomembnejši čim krajši čas intervencije (»Time is Brain«). Obravnava je večplastna in zahteva dobro organiziran zdravstveni sistem z ustrezno tehnično opremo in usposobljenimi strokovnjaki. Ključna sta čim hitrejši transport v bolnišnico ter hitra in natančna diagnostika. Na osnovi diagnostičnih izvidov se izbere najprimernejše zdravljenje, v primeru ishemične možganske kapi bodisi intravenska tromboliza (razgradnja krvnega strdka) bodisi endovaskularna trombektomija. Za trombolizo sta na voljo dve učinkovini, alteplaza, ki je rekombinantna oblika tkivnega aktivatorja plazminogena (tPA) 13, in tenekteplaza, ki je genetsko spremenjen tPA z daljšim razpolovnim časom, večjo specifičnostjo za fibrin in manjšo dovzetnostjo za inhibitorje 14. Trombektomija je mehanska odstranitev krvnega strdka s pomočjo sesalnega žilnega katetra. Večini bolnikov ta poseg sicer koristi, pri nekaterih pa ni uspešen oz. jim celo škodi. Predpostavlja se, da do tega pride zaradi kolapsa distalnih kapilar ali njihovega poškodovanega epitela, porušitve strukture krvno-možganske pregrade in/ali krčenja pericitov 15.
Po končanem primarnem zdravljenju se je potrebno posvetiti preprečevanju ponovnega pojava ishemične možganske kapi z rednim uživanjem manjših odmerkov acilsalicilne kisline (Aspirin), dipiridamola in klopidogrela, samostojno ali v kombinacijah drug z drugim, ter vseh pristopov t. i. sekundarne prevencije. V vseh fazah obravnave možganske kapi je seveda potrebno preprečiti morebitne pridružene komplikacije, kot so aspiracijska pljučnica, venski tromboembolizem in preležanine 16.
Revolucionaren napredek lahko pričakujemo s terapevtsko uporabo nevralnih matičnih celic 17. Pri živalskih modelih sta učinkovitost in varnost tovrstnega zdravljenja že bili potrjeni, a kliničnih študij na ljudeh je bilo opravljenih le nekaj. Najobetavnejša med njimi je uspešno prestala prvo fazo z vzpodbudnimi rezultati, a so ugotovitve vprašljive, saj je vključevala le 11 bolnikov brez kontrolne ali placebo skupine 18. Več si obetamo od zaključene druge faze klinične študije.
Celična in molekularna patofizologija
Celično-molekularna ishemična kaskada. Posledice motenega pretoka krvi (»perfuzije«) na celičnem nivoju so pri živalskih modelih, predvsem glodalcih, dobro poznane 19 in so omogočile postavitev modelov patologije ishemične možganske kapi (slika 2). Ti modeli so dobro podprti tudi s človeškimi in vitro, slikovnimi in post mortem študijami navkljub bistvenim razlikam glede strukture možganov, mehanizma koagulacije in splošne funkcionalne kompleksnosti. Poznavanje celične in molekularne patofiziologije je pomembno, saj bi lahko poleg uveljavljenega t. i. anatomskega zdravljenja identificirali biološke molekule, ki so odgovorne za negativne posledice ishemične možganske kapi, in nanje vplivali s farmakoterapevtiki.
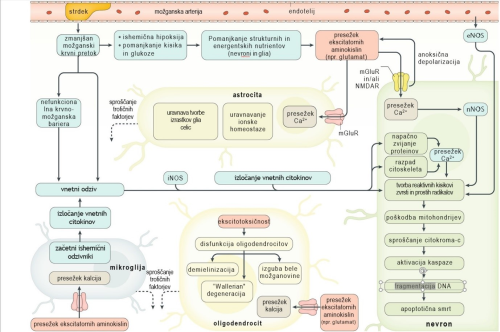
Slika 2: Shematski prikaz celično-molekularne kaskade ishemične možganske kapi. mGluR – metabotropični glutamat receptor, NMDAR – N-metil-D-glutamat receptor, eNOS – endotelna dušikov oksid sintaza, iNOS – inducibilna dušikov oksid sintaza, nNOS – nevralna dušikov oksid sintaza (prirejeno po 7).
Pri ishemični možganski kapi krvni strdek povzroči zmanjšan oz. prekinjen dotok krvi v določen predel možganov. Izmed vseh hranil in signalnih molekul, ki sestavljajo kri, celice prizadetega predela najprej prizadene pomanjkanje kisika. Vsi celični procesi so namreč neposredno odvisni od energijskega vira v obliki molekul adenozintrifosfata (ATP), za sintezo katerih sta potrebna kisik in glukoza. Celice lahko shranjujejo določeno količino glukoze, ne pa kisika. Glavne celične energetske »tovarne« so mitohondriji, ki so poleg zmanjšane proizvodnje ATP prizadeti tudi s povečanimi koncentracijami Ca2+, z aktivacijo proteaz ter s sproščanjem pro-apoptoznih faktorjev in prostih radikalov 20. Nevroni ne morejo več vzdrževati transmembranskega potenciala, zaradi česar pride do anoksične depolarizacije, zaradi nje pa do sproščanja nevrotransmiterjev iz presinaptičnih aksonov. Ker je tudi za razgradnjo oz. ponovni privzem nevrotransmiterjev potreben ATP, do tega ne pride in koncentracije nevtrotransmiterjev v sinapsah ostanejo nekontrolirano visoke 21.
Naslednji problem predstavlja receptor za N-metil-D-aspartat (NMDA). Pri mirovnem transmembranskem potencialu je kanalček tega receptorja zaprt zaradi blokade z zunajceličnimi Mg2+. Zaradi anoksične depolarizacije se kanalček odpre in v celico vdre Ca2+, kalcijevi kationi se dodatno sprostijo še iz znotrajceličnih zalog in ker je Ca2+ pomemben sekundarni obveščevalec, sproži mnoge celične procese 22. Ključna je od Ca2+ odvisna nevronalna dušikov oksid sintaza (nNOS), ki poveča sintezo NO ter posledično tvorbo reaktivnih kisikovih zvrsti in prostih radikalov 23, to pa vodi do aktiviranja mehanizmov celične smrti (apoptoza, nekroza, nekroptoza, avtofagija). Ta propad sinaptičnih aksonov po britanskem nevrofiziologu Augustusu V. Wallerju imenujemo Wallerjeva degeneracija (angl. Wallerian degeneration) 24. V preostalih delih nevronov sčasoma zmanjka ubikvitina (regulatorni protein, ki odloča o usodi drugih proteinov), zaradi česar pride do prekinjenega odstranjevanja oksidativno poškodovanih proteinov in njihovo združevanje v vse večje skupke 25.
Citotoksičnim procesom sledi aktivacija imunskega sistema. Najprej se odzovejo najbližje celice mikroglija, nato vdrejo krvni makrofagi, nevtrofilci in nazadnje limfociti 26. Mikroglija in makrofagi nastopijo v ameboidno fagocitnem fenotipu ter se lotijo odstranjevanja razpadlih delov celic. Makrofagi v tej obliki izražajo poglavitni kompleks tkivne skladnosti tip 1 (MHC-I) (predstavitev antigenov), NADPH oksidazo (tvorba prostih radikalov) in inducibilno NOS (sinteza NO). Kasneje se fenotip makrofagov spremeni, na površini začnejo izražati manozo in haptoglobulinski receptor, v povezavi z zavrto fagocitozo in manjšim izločanjem vnetnih citokinov (IFN-γ, IL-1) 27. Terapevtski potencial ciljanja imunskega sistema je slabo raziskan. Aplikacija IL-1 se je pri živalskih modelih sicer izkazala za zaščitno 28, medtem ko je uporaba natalizumaba (humanizirano monoklonsko protitelo proti α4-integrinu) dala nekonsistentne rezultate 29.
Sfingolipidna signalna pot. V možganih obstaja mnogo signalnih poti in omrežij, a v povezavi z ishemično možgansko kapjo je najpomembnejši regulator sfingolipidna signalna pot. Od njene aktivnosti so odvisni jakost, trajanje in obseg prizadetosti po ishemični možganski kapi. Sfingolipidi so skupina lipidov, ki nastanejo s kontrolirano razgradnjo sestavin celične membrane, pomembno vlogo pa imajo pri viabilnosti, proliferaciji, vzdražnosti, migraciji in smrti celic. Ključni signalni molekuli sta sfingozin-1-fosfat in ceramid, pri čemer je prva pro-, druga pa antiapoptotična. Fiziološko relevantno je predvsem njuno razmerje in od njega je odvisno, na kakšen način bo potekala migracija limfocitov, aktivacija glija celic, krčenje prepustnosti krvnih žil ter preživetje nevronov 30.
Osnovni princip tarčenja sfingolipidne signalne poti ni v odpravljanju že povzročene škode zaradi možganske kapi, ampak v preprečitvi njenega širjenja. Zgoraj opisana ishemična kaskada se namreč iz primarno prizadetega predela možganov širi drugam, in ravno to je mogoče preprečiti. Večina do sedaj opravljenih in vitro ter in vivo predkliničnih študij je potrdila terapevtski potencial modulacije receptorja za sfingozin-1-fosfat (npr. 31). V raziskavah se najpogosteje uporablja fingolimod, poznan kot zaviralec imunskega odziva, ki pa je v primeru ishemične možganske kapi pokazal tudi neposredno zaščitno delovanje na nevrone. Mehanizem vključuje zaviranje transporta inducibilnih faktorjev apoptoze (AIF) v celično jedro in inhibicijo cepitve kaspaze-3, s sočasno povečano ekspresijo antiapoptotičnih faktorjev ERK 1/2, PKB/Akt in Bcl-2 32. Na klinično uporabo modulacije sfingolipidne signalne poti pri zdravljenju možganske kapi bo potrebno še počakati.
Zaključek
Namesto klasičnega zaključka pa kot zanimivost povzetek najnovejše študije, ki razkriva povezavo med ishemično možgansko kapjo in obolevnostjo za COVID-19, ki jo povzroča trenutno najbolj splošno znan virus, SARS-CoV-2 33. Od začetka epidemije SARS-CoV-2 so se pojavljala posamezna poročila o visokem deležu sočasne pojavnosti ishemične možganske kapi in COVID-19, omenjena študija pa je združila vse podatke in med seboj primerjala dve skupini po 336 bolnikov s kronično možgansko kapjo – tiste z diagnosticirano okužbo s SARS-CoV-2 in tiste brez nje. Zaključek študije na osnovi izčrpne statistične analize razkriva, da imajo bolniki s COVID-19 hujše epizode ishemične možganske kapi, s hujšimi posledicami ter z večjo smrtnostjo. Zaradi same zasnove študije in trenutnega pomanjkanja védenja o posledicah okužbe s SARS-CoV-2 za druge organske sisteme poleg dihalnega o vzročno-posledičnih povezavah med COVID-19 in možgansko kapjo ni mogoče sklepati, presečna patofiziologija pa je predmet nadaljnjih raziskav.
-
___
-
Feigin VL, Nguyen G, Cercy K, et al. Global, Regional, and Country-Specific Lifetime Risks of Stroke, 1990 and 2016. New England Journal of Medicine. 2018;379:2429-2437. ↩
-
Johnson CO, Nguyen M, Roth GA, et al. Global, Regional, and National Burden of Stroke, 1990-2016: a Systematic Analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 2019;18:439-458. ↩
-
Krishnamurthi RV, Feigin L, Forouzanfar MH, et al. Global and Regional Burden of First-Ever Ischaemic and Haemorrhagic Stroke During 1990-2010: Findings from the Global Burden of Disease Study 2010. Lancet Global Health. 2013;1:e259-e281. ↩
-
Bevan S, Traylor M, Adib-Samii P, et al. Genetic Heritability of Ischemic Stroke and the Contribution of Previously Reported Candidate Gene and Genome-Wide Associations. Stroke. 2012;43:3161-3167. ↩
-
O’Donnell MJ, Xavier D, Liu L, et al. Risk Factors for Ischaemic and Intracerebral Haemorrhagic Stroke in 22 Countries (the INTERSTROKE Study): a Case-Control Study. Lancet. 2010;376:112-123. ↩
-
Linday MP, Norving B, Sacco RL, et al. WSO global stroke fact sheet. International Journal of Stroke. 2019;14:806-817. ↩
-
Campbell BCV, De Silva DA, Macleod MR, et al. Ishaemic Stroke. Nature Reviews: Disease Primers. 2019;5:70. ↩
-
Bal S, Bhatia R, Menon BK, et al. Time Dependence of Reliability of Noncontrast Computed Tomography in Comparison to Computed Tomography Angiography Source Image in Acute Ischemic Stroke. International Journal of Stroke. 2015;10:55-60. ↩
-
McGarry BL, Damion RA, Chew I, et al. A Comparison of T2 Relaxation-Based MRI Stroke Timing Methods in Hyperacute Ischemic Stroke Patients: A Pilot Study. Journal of Central Nervous System Disease. 2020;12:1-13. ↩
-
Misra S, Montaner J, Ramiro L, et al. Blood Biomarkers for the Diagnosis and Differentiation of Stroke: a Systematic Review and Meta-Analysis. International Journal of Stroke. 2020;15;704-721. ↩
-
Lee E-J, Kim Y-H, Kim N, et al. Deep into the Brain: Artificial Intelligence in Stroke Imaging. Journal of Stroke. 2017;19:277-285. ↩
-
Liebeskind DS, Malhotra K, Hinman JD. Imaging as the Nidus of Precision Cerebrovascular Health: a Million Brains Initiative. JAMA Neurology. 2017;74:257-258. ↩
-
Hacke W, Kaste M, Fieschi C, et al. Randomised Double-Blind Placebo-Controlled Trial of Thrombolytic Therapy with Intravenous Alteplase in Acute Ischaemic Stroke (ECASS II). Second European-Australasian Acute Stroke Study Investigators. Lancet. 1998;352:1245-1251. ↩
-
Tanswell P, Modi N, Combs D, et al. Pharmacokinetics and Pharmacodynamics of Tenecteplase in Fibrinolytic Therapy of Acute Myocardial Infarction. Clinical Pharmacokinetics. 2002;41: 1229-1245. ↩
-
Bai J, Lyden PD. Revisiting Cerebral Postischemic Reperfusion Injury: New Insights in Understanding Reperfusion Failure, Hemorrhage, and Edema. International Journal of Stroke. 2015;10:143-152. ↩
-
Rajah BG, Ding Y. Experimental Neuroprotection in Ishemic Stroke: a Concise Review. Neurosurgical Focus. 2017;42:E2. ↩
-
Zhang G-L, Zhu Z-H, Wang Y-Z. Neural Stem Cell Transplatation Therapy for Brain Ishemic Stroke: Review and Perspectives. World Journal of Stem Cells. 2019;11:817-830. ↩
-
Kalladka D, Sinden J, Pollock K, et al. Human Neural Stem Cells in Patients with Chronic Ishaemic Stroke (PISCES): a Phase I, First-in-Man Study. Lancet. 2016;388:787-796. ↩
-
Howells DW, porritt MJ, Rewell SSJ, et al. Different Strokes for Different Folks: the Rich Diversity of Animal Models of Focal Cerebral Ischemia. Journal of Cerebral Blood Flow & Metabolism. 2010;30:1412-1431. ↩
-
Zhang K, Yan J, Wang L, et al. The Pyk2/MCU Pathway in the Rat Middle Cerebral Artery Occlusion Model of Ischemic Stroke. Neuroscience Research. 2018;131:52-62. ↩
-
Obrenovitch TP, Urenjak J, Richards DA, et al. Extracellular Neuroactive Amino Acids in the Rat Striatum During Ischaemia: Comparison Between Penumbral Conditions and Ischaemia with Sustained Anoxic Depolarisation. Journal of Neurochemistry. 1993;61:178-186. ↩
-
Wu QJ, Tymianski M. Targeting NMDA Receptors in Stroke: New Hope in Neuroprotection. Molecular Brain. 2018;11:15. ↩
-
Love S. Oxidative Stress in Brain Ischemia. Brain Pathology. 1999;9:119-131. ↩
-
Harold E. Augustus Volney Waller: Physiologist Who Described Distal Degeneration of Severed Nerve Fibres. British Journal of Hospital Medicine. 2020;81:1-2. ↩
-
Wojcik C, Di Napoli M. Ubiquitin-Proteasome System and Proteasome Inhibition: New Strategies in Stroke Therapy. Stroke2004;35:1506-1518. ↩
-
Chamorro A, Meisel A, Planas AM, et al. The Immunology of Acute Stroke. Nature Reviews Neurology. 2012;8401-410. ↩
-
Dominant Role of Microglial and Macrophage Innate Immune Responses in Human Ischemic Infarcts. Brain Pathology. 2018;28:791-805. ↩
-
Maysami S, Wong R, Pradillo JM, et al. A Cross-Laboratory Preclinical Study on the Effectiveness of Interleukin-1 Receptor Antagonist in Stroke. Journal of Cerebral Blood Flow & Metabolism. 2016;36:596-605. ↩
-
Elkins J, Veltkamp R, Montaner J, et al. Safety and Efficacy of Natalizumab in Patients with Acute Ischaemic Stroke (ACTION): a Randomised, Placebo-Controlled, Double-Blind Phase 2 Trial. Lancet Neurology. 2017;16:217-226. ↩
-
Na Sun MD, Keep RF, Ya Hua MD, et al. Critical Role of the Sphingolipid Pathway in Stroke: a Review of Current Utility and Potential Therapeutic Targets. Translational Stroke Research. 2016;7:420-438. ↩
-
Czech B, Pfeilschifter W, Mazaheri-Omrani N, et al. The Immunomodulatory Sphingosine 1-Phosphate Analog FTY720 Reduces Lesion Size and Improves Neurological Outcome in a Mouse Model of Cerebral Ischemia. Biochemical and Biophysical Research Communications. 2009;389:251-256. ↩
-
Wei Y, Yemisci M, Kim HH, et al. Fingolimod Provides Long-Term Protection in Rodent Models of Cerebral Ischemia. Annals of Neurology. 2011;69:119-129. ↩
-
Ntaios G, Michel P, Georgiopoulos G, et al. Characteristics and Outcomes in Patients With COVID-19 and Acute Ischemic Stroke. Stroke. 2020;51:e254-e258. ↩
ddr. Matjaž Deželak, univ. dipl. biol.
SiNAPSA, slovensko društvo za nevroznanost