Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Možgani pod stresom: od celic do duševnih motenj
letnik 2017, številka 14
uvodnik
Maša Čater
članki
Zakaj ne zapeljem s ceste, ko kihnem?
Anka Slana Ozimič, Grega Repovš
Možgani pod stresom: od celic do duševnih motenj
Nastja Tomat
Nobelova nagrada za odkritje molekularnih mehanizmov nadzora cirkadianih ritmov
Leja Dolenc Grošelj
Na sledi prvi vzročni terapiji Huntingtonove bolezni
Danaja Metul
Razlike med spoloma pri Parkinsonovi bolezni
Kaja Kolmančič
aktualno
Vesna M. van Midden, Dolores Trol
Poročilo z javnega posveta ob zaključku projekta Z možgani za možgane
Sebastijan Krajnc
kolofon
letnik 2017, številka 14
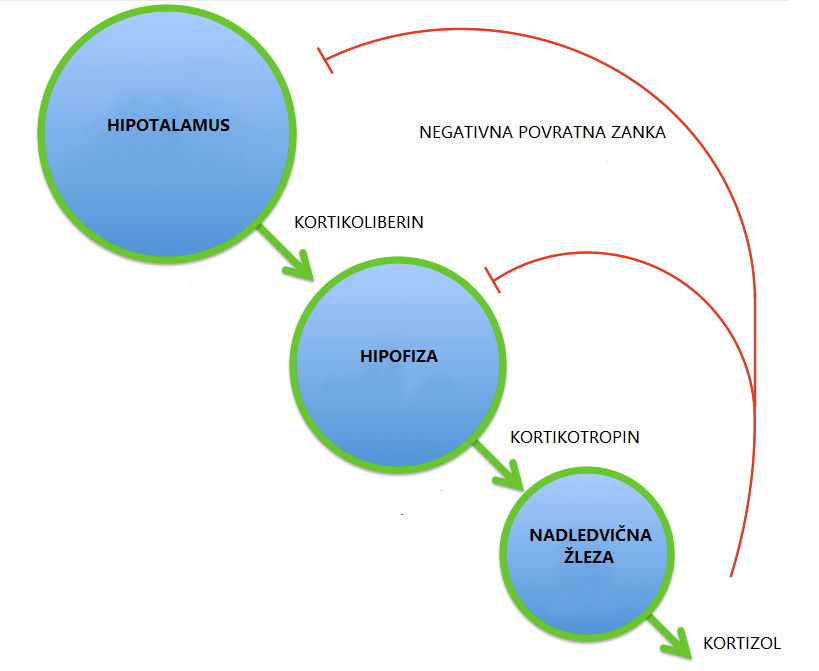
Začetke preučevanja fiziologije stresa označuje delo Walterja Cannona, ki je identificiral vlogo simpatičnega živčnega sistema pri oblikovanju odziva »boj ali beg«, in delo Hansa Seyla, ki je pokazal na pomembnost glukokortikoidov1 ter osi hipotalamus-hipofiza-nadledvična žleza3 pri uravnavanju stresnega odziva.
Os hipotalamus-hipofiza-nadledvična žleza je sistem povezav med omenjenimi strukturami. Prek interakcij z drugimi sistemi (metabolni, imunski) uravnava fiziološke odzive, ki omogočajo prilagajanje različnim stresorjem.2 Z aktivacijo osi se energija organizma preusmeri iz rutinskega ohranjanja homeostaze v procese, ki so potrebni za preživetje – npr. povišana kardiovaskularna aktivnost in metabolizem glukoze. Komunikacija vzdolž osi poteka prek različnih signalnih molekul.3 V hipotalamusu nastajajoči kortikoliberin (ang. corticotropin-releasing hormone, s kratico CRH) spodbuja sproščanje hormona kortikotropina (ang. adrenocorticotropic hormone, s kratico ACTH) v hipofizi, ki vpliva na sproščanje glukokortikoidov v nadledvičnih žlezah. Glukokortikoidi so steroidni hormoni, ki igrajo pomembno vlogo pri uravnavanju stresnega odziva, glavni predstavnik pri ljudeh pa je kortizol.7
Odkritja, da lahko stresni odziv sprožijo psihološki dejavniki – izguba nadzora, predvidljivosti in socialne podpore – so pokazala na vlogo psihologije pri preučevanju stresa; ugotovitve, da daljše doživljanje stresa poviša verjetnost za določene bolezni, pa so opozorila na pomen preučevanje stresa z vidika medicine in spodbudila porajanje novih podpodročij, na primer psihonevroimunologije.1
Vpliv stresa na možgane
Vpliv stresa se kaže na ravni molekul, nevronov, strukture možganov in celotnega organizma. Veliko raziskav se je osredotočalo na tri možganske strukture – hipokampus, amigdalo in prefrontalni reženj. 2 Ta področja tvorijo tridelno kortikolimbično omrežje, ki pri različnih vrstah uravnava tako odzivanje na akutne kot dolgotrajne stresorje.3 Hipokampus igra vlogo pri vkodiranju kompeksnih informacij iz okolja, ki so povezane z grožnjami, prek glukokortikoidnih receptorjev pa podaja povratne informacije osi hipotalamus-hipofiza-nadledvična žleza, ki uravnava stresni odziv.
Veliko raziskav potrjuje negativen vpliv stresa na procese deklarativnega spomina, ki potekajo v hipokampusu, in na izvršilne funkcije ter uravnavanje vedenja, za kar je zadolžen frontalni reženj.1 Stres, posledica katerega je sproščanje velikih količin glukokortikoidov, bo v hipokampusu in nekaterih delih frontalnega režnja zmanjševal plastičnost sinaps, povzročal atrofijo dendritov in celo zmanjševal prostornino sivine ali celotne strukture možganov. Takšne spremembe so med drugim podlaga kognitivne oškodovanosti pri depresiji in posttravmatski stresni motnji (v nadaljevanju PTSM).1 Kognitivna rigidnost je povezana s krčenjem in zmanjšanjem razvejanosti dendritov v medialnem prefrontalnem režnju, prekomerna opreznost in previdnost pa s širjenjem dendritov v orbitofrontalnem režnju. Spremembe nevronov v prefrontalnem režnju so sicer reverzibilne, vendar so dendriti po okrevanju bolj oddaljeni od telesa celice kot prej.2 Tretja struktura, amigdala, pa sodeluje pri prepoznavanju potencialnih nevarnosti, oblikovanju fiziološkega in vedenjskega odziva nanje ter pri ustvarjanju spominov, ki olajšajo nadaljnje predvidevanje okolja in omogočajo ustrezno vedenje.3 V amigdali glukokortikoidi zvišujejo plastičnost sinaps in spodbujajo rast dendritov, kar vodi v spremembe v doživljanju strahu – v manjši potencial za interpretiranje okolja kot varnega in večjo verjetnost za strah v okoliščinah, kjer to ni potrebno. 1
Pomembno je preučevati tako vpliv akutnih kot kroničnih stresorjev. Raziskave, v katerih so preučevali učinek glukokortikoidov na izražanje genov v hipokampusu miši, so pokazale, da kronični stres lahko vpliva na odziv na nove, akutne stresorje. Pri miših, ki so bile najprej izpostavljene enaindvajsetdnevnemu stresu in potem okrevanju, so novi stresorji sprožili drugačen profil izražanja genov kot pri miših, ki niso bile izpostavljene kroničnemu stresu.2
Obrnjena U-krivulja in medosebne razlike v odzivu na stres
Takoj, ko je Seyle populariziral termin stres v biomedicini, se je začela razprava o opredelitvi stresa. Novo vprašanje, ki se poraja iz prvega, se nanaša na medosebne razlike v odzivanju na stres. Kaj je stres – za posameznika? Obstajajo situacije, na primer resna poškodba ali beg pred plenilcem, ki bodo v vsakem organizmu sprožile stresni odziv, v mnogih okoliščinah pa se pripadniki posamezne vrste razlikujejo v tem, katere dražljaje zaznavajo kot stresne, in v njihovi odpornosti ali ranljivosti za razvoj motenj, povezanih s stresom. Vzorec aktivacije mediatorjev stresnega odziva je odvisen od značilnosti, intenzitete in trajanja stresorja. V veliki meri lahko učinke stresorjev na možgane opišemo z obrnjeno U-krivuljo. Časovno omejen stres blage do zmerne intenzivnosti ima koristne učinke; če je stres popolnoma odsoten, prehud ali predolgo časa trajajoč, vpliva škodljivo. Odsotnost stresa večina doživlja kot premalo stimulativno, prehud stres pa kot preveč stimulativno okolje.1 Na podlagi tega sta se oblikovala dva izraza – eustres, ki je opredeljen kot prilagoditveni fiziološki odziv na okolje, in distres, pri katerem se pojavijo motnje v fiziološkem odzivu, kar povzroči, da prilagoditev na okolje ni več uspešna.3 Takšne učinke stresa lahko delno pojasnimo z obstojem dveh vrst receptorjev za glukokortikoide v hipokampusu. Prvi so mineralokortikoidni receptorji, ki večinoma delujejo v nestresnih okoliščinah. Njihova kapaciteta se napolni že pri blagih do zmernih stresorjih. Kapaciteta druge vrste receptorjev, ki se imenujejo glukokortikoidni receptorji, se do konca napolni šele ob izdatnem sproščanju glukokortikoidov, ki je posledica močnega stresa. Višja zasedenost mineralokortikoidnih receptorjev povečuje plastičnost sinaps, višja zasedenost glukokortikoidnih receptorjev pa jo zmanjšuje. Nasprotujoči si učinki dveh vrst receptorjev ustvarjajo obliko obrnjene U-krivulje. Tudi drugi predeli možganov se na stres odzivajo na podoben način, kar raziskovalci razlagajo z različnimi mehanizmi.
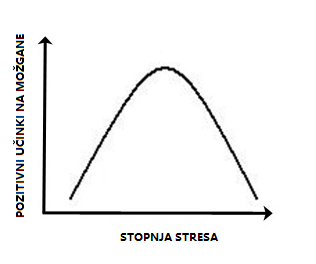
Slika 2. Učinki stresa na številne procese v možganih imajo obliko obrnjene U-krivulje. Prirejeno po Wikimedia Commons.
Stresa, ki je prehoden in ki ga doživljamo v za nas varnem okolju, ne doživljamo kot neprijetnega, temveč kot opreznost, zavzetost, čuječnost.1 Vprašanje, ki se pojavlja, je, kako pri posamezniku vzpostaviti ravnotežje med dolgočasjem in preokupiranostjo ter ohranjati položaj na vrhu krivulje. Predlog za nadaljnje raziskave je preučevanje dejavnikov, ki lahko vrh krivulje pri posamezniku premikajo na levo ali desno stran – v smer večje ranljivosti ali odpornosti. Ne gre za to, kako odpraviti stres, temveč kako optimizirati njegovo raven.1
S stresom povezane motnje
Stres se povezuje tako z razvojem možganov kot z nevroplastičnostjo v odraslosti. Škodljivi vplivi stresa v zgodnjih obdobjih življenja, še posebej v obporodni dobi, se lahko kažejo tudi v odraslosti, spremenijo potek staranja možganov in prek negenetskega prenašanja fizioloških in vedenjskih značilnosti vplivajo celo na več generacij. Raziskave o vplivu stresa na amigdalo nakazujejo na stres kot dejavnik tveganja za nastanek različnih patoloških stanj, kot so depresivne in anksiozne motnje, shizofrenija in številna odvisniška vedenja. Raziskave so se osredotočale bodisi na akutni stres, ki sproži epizodo motnje, bodisi na povezavo med stresom v zgodnjem obdobju življenja in boleznijo v odraslosti.1 Oblikovanje varne navezanosti na eni strani ter zanemarjanje in zloraba na drugi se povezujejo s posameznikovim doživljanjem in vedenjem v socialnem okolju pozneje v življenju.2 Travmatske izkušnje, zanemarjanje v otroštvu in nizka stopnja zaznane socialne podpore so stresorji, ki se pogosto pojavljajo pri posameznikih, ki razvijejo anskiozne motnje ali PTSM.3 Rastoče polje raziskav preučuje epigenetske mehanizme, ki so lahko v ozadju dolgoročnih učinkov stresa. Dokazi o nevroplastičnosti in celo nevrogenezi v odraslosti kažejo na možnosti lajšanja, ustavljanja in izničevanja posledic stresa v zgodnjih obdobjih življenja.1
Različne študije so preučevale nevrološke korelate s stresom povezanih motenj. Pri posameznikih s PTSM je na primer opazna hiperaktivnost amigdale med pogojevanjem strahu in ugašanjem pogojnega odziva, kar se povezuje z vztrajanjem občutka strahu, ki ga doživljajo.3 Motnje v ugašanju strahu pri PTSM so povezane tudi s hipoaktivnostjo hipokampusa in ventromedialnega prefrontalnega režnja.3 Pri nastanku duševnih bolezni, kjer gre za interakcijo med genetskimi in okoljskimi vplivi, je torej pomembno upoštevati posameznikovo občutljivost na stres in njegovo stopnjo izpostavljenosti.1 Pri ljudeh medosebne razlike v odzivnosti amigdale na obrazne izraze, povezane z grožnjo, napovedujejo ranljivost za stres v prihodnosti. Udeleženci študije z relativno aktivnejšo amigdalo naj bi imeli v prihodnjih štirih letih ob izpostavljenosti stresorjem (npr. menjava službe ali selitev) večjo verjetnost za razvoj simptomov depresije ali anksioznosti. Variabilnost aktivnosti amigdale se je izkazala kot boljši napovednik ranljivosti kot samoporočanje o simptomih, nedavne stresne izkušnje ali travma v otroštvu. V drugi študiji na vzorcu vojakov, ki so se udeležili spopada, je bila večja aktivnost amigdale ob procesiranju groženj povezana z verjetnostjo za razvoj simptomov, podobnih PTSM.3
Z razumevanjem stresa do izboljševanja duševnega zdravja
Raziskovanje mehanizmov občutljivosti in plastičnosti možganov v kontekstu stresnega odziva je pomembno za oblikovanje intervencij za obravnavo motenj, povezanih s stresom. V stresnih okoliščinah poteka strukturno preoblikovanje nevronske arhitekture, namen česar je uspešna prilagoditev na izzive iz okolja. Vztrajanje teh sprememb po tem, ko stresorji izginejo, je lahko znak prenizke odpornosti na stres. Z namenom prilagajanja na okolje in ponovne vzpostavitve ravnovesja v organizmu potekajo procesi v osi hipotalamus-hipofiza-nadledvična žleza, avtonomnem živčnem sistemu ter metabolnem in imunskem sistemu, ki jih skupno imenujemo alostaza. Ob veliki količini stresa lahko pride do napak v uravnavanju teh procesov in do patofizioloških sprememb v organizmu, kar imenujemo alostatska preobremenitev. Na alostazo in alostatsko preobremenitev med drugim vpliva način življenja – kajenje, pitje alkohola, prehrana in spalne navade.2 Raziskave na vzorcih zaposlenih v izmenah so pokazale, da motnje spanja in cirkadianega ritma povečujejo tveganje za razvoj psihiatričnih, srčno-žilnih in drugih fizioloških sindromov. V nekaterih raziskavah so pri živalih z motenim cirkadianim ritmom poleg metabolnih sprememb opažali morfološke spremembe prefrontalnega režnja, podobne tistim, ki nastanejo z izpostavljenostjo kroničnemu stresu – na primer krčenje dendritov.3
Ko se izpostavljenost stresorjem konča, se nevronska arhitektura ne vrne v svoje začetno stanje, temveč s procesi nevroplastične adaptacije nastane novo, drugačno stanje. Adaptivno plastičnost možganov, ki poteka brez zunanje pomoči, lahko opredelimo kot prožnost (ang. resilience). Ta se zmanjšuje s staranjem, okrnjena pa je pri motnjah čustvovanja. V skladu s prepričanjem, da je prožnost znak zdravih možganov, se raziskovalci na področju duševnega zdravja osredotočajo na njeno ohranjanje in izboljševanje. Nekateri avtorji predlagajo, da v nadaljnjih raziskavah preučijo možnosti farmakološke in psihoterapevtske obravnave anksioznih motenj, depresije in PTSM, ki bodo temeljile na izboljševanju nevroplastičnosti.2 Pri obravnavi s stresom povezanih motenj se pogosto uporabljajo vedenjske intervencije, ki temeljijo na principu ugašanja, pri čemer gre za prekinitev povezave med brezpogojnim in pogojnim dražljajem. Težava je v začasnosti učinka ugašanja – strah se spontano ali v novih okoljih lahko ponovno pojavi.5 Različne študije na glodavcih in ljudeh so pokazale, da ugašanje lahko znatno oslabi s strahom povezane spomine, če poteka v časovnem intervalu rekonsolidacije, ki sledi ponovni aktivaciji spominov.4 5 6 Upoštevanje ustreznih časovnih oken je torej ključno pri načrtovanju terapevtskih intervencij.6 Poleg psihoterapije se uporabljajo tudi druge metode. Repetitivna transkranialna magnetna stimulacija dorzolateralnega prefrontalnega režnja, ki uravnava delovanje amigdale, lahko pri pacientih s PTSM zmanjša vedenjsko simptomatiko in čezmerno aktivnost osi hipotalamus-hipofiza-nadledvična žleza. Pri nekaterih pacientih s hudo, na zdravljenje odporno, depresijo se je kot učinkovito zdravljenje izkazala globoka možganska stimulacija in raziskovalci upajo na njen terapevtski potencial tudi pri drugih motnjah, npr. PTSM.3
Ugotovitve o skupni genetski arhitekturi in nevronskih omrežjih za uravnavanje stresnega odziva prek različnih vrst govorijo v prid uporabnosti živalskih modelov pri preučevanju vpliva stresa na ljudi. Določene funkcije amigdale, hipokampusa in prefrontalnega režnja pri uravavanju stresnega odziva so analogne tistim pri ljudeh. Nekateri avtorji menijo, da povezovanje prekliničnih študij na glodavcih in študij na zdravih posameznikih ter kliničnih populacijah lahko ponudi odgovore o biološki podlagi motenj, povezanih s stresom. Medosebne razlike v strukturnih in funkcijskih značilnostih nevronskih omrežij, ki uravnavajo stresni odziv, so morda pot do bioloških označevalcev motenj, povezanih s stresom.3
-
___
-
Sapolsky, R. M. (2015). Stress and the brain: individual variability and the inverted-U. Nature Neuroscience, 18(10), 1344–1346. ↩
-
Hariri, A. R. In Holmes, A. (2015). Finding translation in stress research. Nature Neuroscience, 18(10), 1347–1352. ↩
-
McEwen, B. S., Bowles, N. P., Gray, J. D., Hill, M. N., Hunter, R. G., Karatsoreos, I. N. in Nasca, C. (2015). Mechanisms of stress in the brain. Nature Neuroscience, 18(10), 1353–1363. ↩
-
Glucocorticoid (b.d.). Miller-Keane Encyclopedia and Dictionary of Medicine, Nursing, and Allied Health, Seventh Edition (2003). Pridobljeno 26. 10. 2017 z https://medical-dictionary.thefreedictionary.com/glucocorticoid ↩
-
Monfils, M. H., Cowansage, K. K., Klann, E. In LeDoux, J. E. (2009). Extinction-reconsolidation boundaries: key to persistent attenuation of fear memories. Science, 324(5929), 951–955. ↩
-
Agren, T., Engman, Frick, A., Bjorkstrand, J., Larsson, E. M., Furmark, T. In Fredrikson, M. (2012). Disruption of reconsolidation erases a fear memory trace in the human amygdala. Science, 337(6101), 1550–1552. ↩
-
Post, R. M. in Kegan, R. (2017). Prevention of recurrent affective episodes using extinction training in the reconsolidation window: A testable psychotherapeutic strategy. Psychiatry Research, 249, 327–336. ↩
Nastja Tomat, dipl. psih.