Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Kakšne možnosti ponuja metoda draženja globokih možganskih struktur za bolnike v vegetativnem stanju in stanju minimalne odzivnosti
Področje, ki kliče po pojasnitvi
letnik 2013, številka 6
uvodnik
Slepa recenzija za boljšo kvaliteto
Miha Pelko
članki
Odstranjevanje možganskih tumorjev pri budnem bolniku
Andrej Vranič, Jasmina Markovič, Blaž Koritnik
Zmedena bolnica, ki nič ne vidi ali PRES
Manja Hribar, Vid Zgonc
Manja Hribar
Sistemska skleroza in ishemična možganska kap - vzročna povezanost ali le koincidenca?
Mateja Repar, Janja Pretnar Oblak
Netravmatska lokalizirana konveksitetna subarahnoidna krvavitev
Mateja Repar, Fajko F. Bajrović
Klemen Grabljevec
Z omejevanjem spodbujajoča terapija pri bolnikih po nezgodni možganski poškodbi
Dejana Zajc, Klemen Grabljevec
aktualno
Mara Bresjanac, Nadja Jarc
Nena Golob
mnenja
Kaj se lahko naučimo o poškodbi možganov iz knjige »Misli, ki jokajo« avtorja Andreja Pegana
Klemen Grabljevec
Recenzija knjige Pojasnjena zavest
Simon Brezovar
korenine
Mara Bresjanac
kolofon
letnik 2013, številka 6
Metoda draženja globokih možganskih struktur (angl.: „Deep Brain Stimulation - DBS“), konkretno - retikularne formacije in centromedianega-parafascikularnega kompleksa dominantne hemisfere, se je pri izboljšanju odzivnosti bolnikov v vegetativnem stanju le v redkih primerih izkazala za učinkovito do te mere, da so bolniki lahko smiselno komunicirali in izkazovali razumevanje navodil, niso pa bili sposobni samostojnega premikanja. Pri bolnikih v stanju minimalne odzivnosti pa je v večini opisanih primerov prišlo tudi do izboljšanja pomičnosti in osamosvojitve v gibanju.

DRAŽENJE GLOBOKIH MOŽGANSKIH STRUKTUR – VLOGA PRI ZDRAVLJENJU BOLNIKOV Z OKVARO ZAVEDANJA IN ODZIVNOSTI
Uporaba draženja globokih možganskih struktur se je v zadnjih desetletjih razširila na mnoga področja nevroloških, psihiatričnih in nevrokirurških stanj. Terapija se je izkazala kot zelo uspešna na področju motenj gibanja pri ekstrapiramidnih okvarah in pri zdravljenju obsesivno-kompulzivnih motenj 1 2. Eno manj raziskanih in pojasnjenih področij je zdravljenje bolnikov v vegetativnem stanju in stanju minimalne odzivnosti po možganski poškodbi. Poročila o uspešnosti takšne terapije segajo od zmerno pesimističnih 3 4 do evforičnih 5, predvsem pa so bila osnovana na posamičnih primerih ali majhnih vzorcih bolnikov.
Zgodnjo teorijo o možnosti vzpodbujanja zavedanja in odzivnosti s pomočjo draženja subtalamičnih področij in retikularne substance sta opisala Hassler 6 in Moruzzi 7. Nadaljnje raziskave so odkrile pomen, ki ga imajo intralaminarna jedra pri vzdrževanju pozornosti in tvorbi kratkoročnega spomina 8. Odkritje talamično-kortikalnih povezav je še dodatno prispevalo k razkritju pomena talamičnih centrolateralnih jeder pri vzdrževanju budnosti in pozornosti 9.
Mnoga talamična jedra imajo pomembno vlogo pri prenosu senzoričnih in motoričnih informacij. Izboljšanje biokemičnega zaznavanja nevronskih karakteristik je pripomoglo k identifikaciji specifičnega tipa kalbind in pozitivnih talamičnih nevronov, ki za razliko od običajnih internevronov svoje aksone razpršeno podaljšujejo v kortikalna področja, vključno s frontalnim režnjem in drugimi področji, ki niso vključena v prenos motoričnh ali senzoričnih informacij 2 10.
Trajni implantabilni sistem za draženje globokih možganskih struktur se v rutinski klinični praksi uporablja od 70-ih let prejšnjega stoletja dalje 11. Nevrokirurški poseg s pomočjo 3D-stereotaktične kirurgije obsega implantacijo dveh žičnih elektrod s po štirimi stimulacijskimi terminalnimi elektrodami, npr. v področje subtalamičnih jeder (slika 1). Žične elektrode so podkožno povezane s stimulatorjem, ki je implantiran v področje pod ključnico. Sam postopek in položaj elektrod je opisan v relevantni literaturi 12 13 14 in opisovanje le tega bi presegalo okvire tega prispevka.
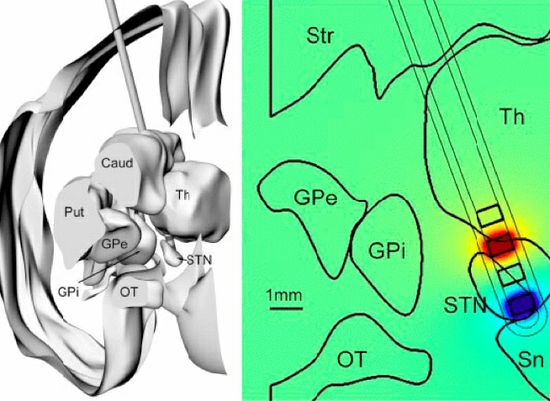
Slika 1: Položaj stimulacijskih elektrod v talamičnem področju (prirejeno po Yamamoto et al. 2010). Caud: caudatum; Put: Putamen; Str: Striatum; GPe: Globus pallidus externum; GPi: Globus pallidus internum; OT: optična pot; Th: Talamus z retikularnim talamičnim jedrom; STN: Subtalamično jedro; Sn: Substantia nigra.
PREGLED LITERATURE IN SLOVENSKE IZKUŠNJE Z UPORABO DRAŽENJA GLOBOKIH MOŽGANSKIH STRUKTUR PO POŠKODBI
Hassler 6 s sodelavci je prvi poročal o bolj izraženi budnosti, spontanem gibanju levih udov, obračanju proti predmetom in osebam ter pojavu nefunkcionalne vokalizacije pri bolniku po petih mesecih vegetativnega stanja po možganski poškodbi, kateremu so devetnajst dni stimulirali desni palidum in levo latero-polarno talamično jedro. Ob tem je prišlo tudi do elektroencefalografskih sprememb v smislu izginotja delta aktivnosti levo temporalno, redukcije asimetrije in delne vzpostavitve ritma alfa. Po ukinitvi draženja je večina opisanih učinkov izzvenela.
Sturm 15 s sodelavci je poročal, da je draženje polarnega retikularnega subtalamičnega jedra pri bolniku po infarktu v področju mezencefalona pripeljalo do zanesljivejšega sledenja navodilom, daljšega stanja budnosti, govornega sporazumevanja in zanesljivejšega vnosa hrane. Stanje bolnika pred kirurškim posegom so sicer opisali kot vmesno stanje med komo in tipičnim apaličnim sindromom, kar je bil v tedanjih časih izraz za današnje vegetativno stanje. Bolnik je umrl dva meseca po vstavitvi sistema trajnega draženja.
Tsubokawa s sodelavci 3 je opisal osem bolnikov v vegetativnem stanju v trajanju vsaj šest mesecev, katerim so implantirali sistem za trajno draženje retikularne formacije in nespecifičnih subtalamičnih jeder. Trije bolniki so imeli poškodbeno okvaro možganov, dva anoksično okvaro in trije bolniki so utrpeli spontano intracerebralno in/ali subarahnoidalno krvavitev. Predhodna nevrofiziološka ocena je obsegala EEG preiskavo, oceno somatosenzoričnih evociranih potencialov (SEP in SSEP) ter oceno akustičnih potencialov možganskega debla (APMD). Nevrološka ocena je povzela točkovanje po nestandardizirani lestvici in je ocenjevala odzivanje na bolečino, spontano odpiranje oči, spontane gibe udov, gibanje zrkel, čustveni odziv, oralni vnos hrane, vokaliziranje, upoštevanje navodil in verbalni odziv. Šest mesecev po uvedbi trajnega draženja sta dva bolnika dosegla zanesljivo oralno komunikacijo, izpolnjevanje navodil, ustrezen čustveni odziv in oralni vnos hrane. Oba bolnika sta utrpela spontano intracerebralno krvavitev. En bolnik je po spontani intracerebralni krvavitvi izkazoval delno in nekonsistentno izpolnjevanje navodil, sledil je predmetom z gibanjem zrkel in spontano gibal z udi. Pri ostalih petih bolnikih – vključno z vsemi tistimi po možganski poškodbi - ni prišlo do pomembnega izboljšanja kliničnega stanja oziromado stanja izboljšane odzivnosti. Avtorji so ugotovili, da je do prve ocene učinka trajnega draženja globokih možganskih struktur potrebno počakati najmanj tri do štiri mesece. Učinek draženja naj ne bi bil evidenten le v zgodnjem odzivu aktivacije ascendentnega aktivacijskega sistema v retikularni substanci, ampak predvsem v povečanju možganskega krvnega pretoka in presnove glukoze v možganski skorji in talamusu. To dvoje naj bi v teh področjih in tudi v okolici induciralo nevroplastičnost in pripomoglo k povrnitvi zavedanja bolnikov v vegetativnem stanju.
Schiff 5 je po vstavitvi trajnega draženja subtalamičnega parafascikularnega jedra šest let po možganski poškodbi bolnika, skupaj s sodelavci, šest mesecev opazoval parametre lestvice „JFK Coma recovery Scale – Revised“ med obdobji dvojno slepega vklopljenega in izklopljenega draženja. Pred začetkom opazovalnega obdobja so izvedli t.i. titracijsko dobo draženja, ki so jo začeli petdeset dni po implantaciji in je trajala pet mesecev. Med titracijsko dobo so določili optimalne parametre ter kombinacije frekvence in intenzitete stimulacije. Poleg primarnih opazovanih parametrov, zajetih v lestvici „JFK Coma recovery Scale – Revised“, so določili tudi sekundarne opazovane parametre in sicer poimenovanje predmetov, premikanje udov na poziv in oralno uživanje hrane. Avtorji opisujejo, da je prišlo do zanesljive korelacije med obdobjem vklopljenega draženja in kvalitativnimi spremembami v vedenju bolnika: daljših obdobij odprtih oči, uboganja motoričnih navodil, poizkusa funkcionalne uporabe predmetov in smiselne verbalizacije. Tovrstni pojavi pred začetkom draženja niso bili prisotni.
Največjo skupino bolnikov po vstavitvi draženja globokih možganskih struktur je opisal Yamamoto s sodelavci 16. Ta študija predstavlja podaljšano opazovalno obdobje skupine bolnikov, ki jo je opisal že Tsubokawa. Poseg so opravili enaindvajsetim bolnikom v vegetativnem stanju, ki so ustrezali kriterijem Delovne skupine za vegetativno stanje, v trajanju med četrtim in osmim mesecem po poškodbi oz. akutnem dogodku. V kontrolni skupini je bilo 86 bolnikov, ki so prav tako ustrezali kriterijem vegetativnega stanja. Povprečna starost bolnikov v skupini, ki je imela vstavljen stimulator je bila 44 let (min. 19; max. 72). Vzrok za okvaro možganov je bil pri devetih bolnikih možgansko-žilni dogodek, v devetih primerih poškodba možganovine in pri treh bolnikih anoksija. Dvema bolnikoma so elektrode vstavili v področje mezencefalne retikularne formacije, devetnajstim pa v področje subtalamičnega centromedianega – parafascikularnega (CMpf) kompleksa dominantne hemisfere. Pred odločitvijo o vstavitvi stimulatorja so pri vseh bolnikih ocenili akustične potenciale možganskega debla (APMD) za oceno funkcije možganskega debla, somatosenzorične potenciale (SEP) nad primarno somatosenzorno skorjo za oceno talamično-kortikalne povezave in spremljali P250 komponento za oceno prisotnih višjih živčnih dejavnosti, opravili kontinuirano EEG snemanje ter frekvenčno analizo za oceno povezave med možganskim deblom in možgansko skorjo. Bolnike v študijski skupini so spremljali najmanj deset let po vstavitvi stimulatorja oziroma do smrti, če je ta nastopila prej. Bolnike v kontrolni skupini so spremljali dve leti.
V študijski skupini so pri vseh enaindvajsetih bolnikih neposredno po vklopu draženja opazili zgodnji odziv (angl.: „arousal effect“) bolnikov: odpiranje oči z dilatiranimi zenicami, spremembo arterijskega tlaka in srčne frekvence ter odpiranje ust. Bolnikom so draženje aktivirali preko dneva, po 30 minut na vsaki dve do tri ure. Od enaindvajsetih bolnikov v študijski skupini jih je v obdobju od štirih mesecev do enega leta po vklopu draženja osem začelo kazati znake razumevanja, govornega sporazumevanja ali sporočanja s kimanjem ter uboganja motoričnih navodil . Od teh osmih bolnikov jih je sedem ostalo popolnoma nesamostojnih in negibnih, en bolnik pa je napredoval do gibanja s pomočjo vozička. Ostalih trinajst bolnikov v študijski skupini je ostalo v vegetativnem stanju. V kontrolni skupini nihče od šestinosemdesetih bolnikov, ki so jih spremljali dve leti ni izšel iz vegetativnega stanja. Ista skupina raziskovalcev je spremljala tudi učinek draženja globokih možganskih struktur na bolnike v stanju minimalne odzivnosti. Od petih bolnikov so po vstavitvi draženja vsi pokazali zanesljivo sporazumevanje z okolico, štirje od petih pa so postali pomični na vozičku ali z drugimi pripomočki in so bili odpuščeni v domače okolje. En bolnik v tej skupini je ostal nepomičen. Avtorji študije zaključujejo, da je metoda z draženjem globokih možganskih struktur primerna za tiste bolnike, ki na nevrofizioloških preiskavah izkazujejo še prisotne povezave med možganskim deblom in možgansko skorjo ter ohranjene talamokortikalne povezave. Takojšen učinek zbujanja v smislu odpiranja oči in nihanja arterijskega tlaka ter srčne frekvence je ugoden napovedni dejavnik za dolgoročni učinek draženja. Vsi bolniki v študiji, pri katerih je prišlo do povrnitve odzivnosti so imeli elektrode vstavljene v področje centromedianega parafascikularnega kompleksa, zato avtorji to področje priporočajo kot ustrezno. Pomemben zaključek študije je, da v primerjavi s študijsko skupino, v kontrolni skupini ni prišlo do spontane povrnitve zavedanja pri nobenem bolniku.
V letu 2011 je bila po priporočilu Oddelka za rehabilitacijo po možganskih poškodbah URI Soča in ob pozitivnem mnenju konzilija KO za nevrokirurgijo UKC Ljubljana na vstavitev stimulatorja globokih možganskih struktur, na stroške ZZZS v tujino napotena ena bolnica. Druga bolnica je odšla na zdravljenje v tujino na pobudo svojcev in brez predhodnega zdravniškega mnenja. Prva bolnica je pol leta pred vstavitvijo sistema utrpela hipoksično možgansko okvaro po srčnem zastoju, druga bolnica pa leto in pol pred posegom difuzno aksonsko poškodbo. Pri obeh bolnicah je bil po vklopu stimulacije opažen takojšen učinek pogostejšega odpiranja oči in nihanja arterijskega tlaka, do spremembe odzivnosti pa ni prišlo pri nobeni. Žal je pri obeh bolnicah po posegu prišlo do kliničnih zapletov v obliki sistemskih okužb, ki so zahtevale dodatno zdravljenje na KO za infekcijske bolezni oz. KO za pljučne bolezni. Bolnica s hipoksično možgansko okvaro je umrla pet mesecev po posegu zaradi septičnega stanja, ki je bil zaplet okužbe zaradi cistostomskega katetra.
ZAKLJUČEK
Terapija z draženjem globokih možganskih struktur pri bolnikih v vegetativnem stanju ali stanju minimalne odzivnosti ni primerna metoda za splošno uporabo, saj se tudi v primerih, ko se klinično stanje bolnikov zdi enako, bazalna možganska aktivnost od bolnika do bolnika zelo razlikuje. Za ocenjevanje le-te avtorji priporočajo predhodno oceno talamo-kortikalnih in mezencefalo-kortikalnih povezav s pomočjo nevrofizioloških metod, predvsem somatosenzoričnih evociranih potencialov, akustičnih potencialov možganskega debla in kontinuiranega snemanja EEG ter - če je mogoče - tudi slikanje s pozitronsko tomografijo (PET) ali funkcijsko magnetno resonanco (f-MRI). Prognostični dejavniki, ki bi lahko nakazovali uspešnost metode niso znani. Pred odločitvijo o uporabi draženja globokih možganskih struktur je torej potrebno najprej zanesljivo določiti stanje bolnikove zavesti in odzivnosti po kliničnih kriterijih in nato opraviti opisane diagnostične preiskave, predvsem pa presojati smiselnost posega na individualni ravni oz. glede na specifičnost posameznega primera.
(Eng.)
A REVIEW OF POSSIBILITIES WITH THE DEEP BRAIN STIMULATION METHOD FOR PATIENTS IN VEGETATIVE STATE AND MINIMALLY CONSCIOUSNESS STATE –A QUESTION WITHOUT AN ANSWER
With the „Deep Brain Stimulation – DBS“ method, usually the region of centromedian – parafascicular complex in dominant hemisphere is stimulated via implanted electrodes. Method showed to be effective in rare cases of patients in vegetative state by improving awareness and responsiveness to external stimuli and ability to communicate, but no improvement of motorical control was observed. There was more ramarkable improvement in the group of patients in „Minimally conscious state“, who were able of independent ambulation and reached some degree of independence in daily activities.
-
___
-
Hariz MI, Blomstedt P, Zrinzo L. Deep brain stimulation between 1947 and 1987: the untold story. Neurosurg focus 2010; 29: E1 ↩
-
Kuehn BM. Scientists probe deep brain stimulation: some promise for brain injury, psychiatric ilness. JAMA 2007; 298: 2249-51. ↩
-
Tsubokawa T, Yamamoto T, Katayama Y, Hirayama T, Maejima S, Moriya T. A Post-acute level of consciousness scale for assessment of young patients with prolonged disturbed consciousness after brain injury. Brain inj. 1990; 4: 315-27. ↩
-
Yamamoto T, Katayama Y. Deep brain stimulation therapy for the vegetative state. Neuropschy rehabil 2005; 15: 406-13. ↩
-
Schiff ND, Giacino JT, Kalmar K, Victor JD, Baker K, Gerber M. Behavioural improvements with thalamic stimulation after severe traumatic brain injury. Nature 2007; 448: 600-3. ↩
-
Hassler R, Dalle Ore G, Dickermann G, Bricolo A, Dolce G. Behavioural and EEG arousal induced by stimulation of unspecific projection systems in patient with post-traumatic apallic syndrome. Electroencephalogr clin neuropsychol 1969; 27: 306-10. ↩
-
Moruzzi G, Magoun HW. Brain stem reticular formation and activation of the EEG. Jour neuropsych clin neurosc 1995; 7: 251-67. ↩
-
Kinomura S, Larsson J, Gulyas B, Roland PE. Activation by attention of the human reticular formation and thalamic intralaminar nuclei. Science 1996; 271: 512-5. ↩
-
van der Werf YD, Witter MP, Groenwegen HJ. The intralaminar and midline nuclei of the thalamus. Anatomical and functional evidence for participation in processes of arousal and awareness. Brain res rev 2002; 39: 107-40. ↩
-
Sen AN, Campbell PG, Yadla S, Jallo J, Sharan AD. Deep brain stimulation in the management of disorders of consciusness: a review of physiology, previous reports and ethical considerations. Neurosurg focus 2010; 29: E14. ↩
-
Schiff ND, Giacino JT, Fins JJ. Deep brain stimulation, neuroethics and the minimally consciuos state: moving beyond proof of principle. Arch neurol 2009; 66: 697-702. ↩
-
Starr PA, Christine CW, Theodosopoulos PV, Lindsey N, Byrd D, Mosley A, Marks WJ. Implantation of deep brain stimulators into subthalmic nucleus: technical approach and magnetic imaging-verified electrode locations. Jour neurosurg 2002; 97: 370-87. ↩
-
http://professional.medtronic.com/pt/neuro/dbs-md/index.htm ↩
-
Miocinovic S, Parent M, Butson CR, Hahn PJ, Russo GS, Vitek JL et al. Computational analysis of subthalamic nucleus and lenticular fasciculus activation during therapeutic deep brain stimulation. J neurophysiol 2006; 96: 1569-80. ↩
-
Sturm V, Kuehner A, Schmitt HP, Assmus H, Stock G. Chronic electrical stimulation of the thalamic unspecific activating system in a patient with coma due to midbrain and upper brain stem infarction. Acta neurochir 1979; 47: 235-44. ↩
-
Yamamoto T, Katayama Y, Kobayashi K, Oshima H, Fukaya C, Tsubokawa T. Deep brain stimulation for the treatment of vegetative state. Euro j neurosci 2010; 32: 1145-51. ↩
mag. Klemen Grabljevec, dr. med.
Oddelek za rehabilitacijo bolnikov po možganski poškodbi, z multiplo sklerozo in
živčno-mišično boleznijo
Univerzitetni rehabilitacijski Inštitut-Soča