Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Možganska omrežja pri nevrodegenerativnih boleznih
letnik 2023, številka 24
članki
Možganska omrežja pri nevrodegenerativnih boleznih
Tomaž Rus, Matej Perovnik
Morske živali kot navdih za nevroznanstvenike: morski konjiček, morski zajček in klobučnjak
Tina Bregant
Metoda Feldenkrais: gibanje in nevroplastičnost
Mateja Pate
Etično naravnana animalna nevroznanost
Maša Čater
Helena Motaln, Boris Rogelj
zdravje
kolofon
letnik 2023, številka 24
Nevrodegenerativne bolezni, ki se klinično izrazijo kot demenca ali motnje gibanja, so med najpomembnejšimi javnozdravstvenimi izzivi sodobnega časa. Z napredkom razvoja zdravil, ki spreminjajo njihov potek, postajajo vse pomembnejši natančni biološki označevalci, ki nam omogočajo zgodnjo diagnozo in spremljanje napredovanja bolezni. Različne nevrodegenerativne bolezni, med katerimi sta najpogostejši Alzheimerjeva in Parkinsonova bolezen, označujejo specifična patološka funkcijska omrežja. Ta omrežja lahko pri bolnikih zaznamo z raznovrstnimi slikovnimi metodami, med katerimi sta najbolj uveljavljeni pozitronska emisijska tomografija z [18F]-fluorodeoksiglukozo (FDG PET) ter funkcijska magnetna resonanca v mirovanju (angl. resting state functional magnetic resonance imaging; rs-fMRI). Omenjena omrežja nam omogočajo vpogled v mehanizme bolezni in vivo in natančno razlikovanje med podobnimi sindromi.
Podatke, ki jih pridobimo s funkcijskimi slikovnimi preiskavami, lahko analiziramo na več načinov. Pri slikanju FDG PET lahko pri posameznem preiskovancu preučujemo prostorsko razporeditev glukoze z radioaktivnim elementom ([18F]-fluorodeoksiglukoza), ki se v možganovini kopiči skladno z presnovnimi potrebami, kar korelira z aktivnostjo nevronov 1. Z uporabo enostavnih, univariatnih statističnih metod, ki primerjajo posamezne voksle ali regije med bolnikom (bolniki) in zdravimi preiskovanci, lahko prikažemo tiste dele, ki se statistično značilno razlikujejo med skupinama. Na tak način pomembno izboljšamo kontrast slike 2. Napredni algoritmi, ki ne analizirajo le posameznih možganskih vokslov/regij, temveč upoštevajo tudi odnose med njimi (npr. korelacije) pa nam omogočajo vpogled v soodvisnost oz. povezanost med različnimi predeli možganov. Ti predeli tvorijo možgansko omrežje. V ta namen so različne raziskovalne skupine razvile več analitičnih metod, med katerimi se najpogosteje uporabljajo tiste, ki temeljijo bodisi na analizi osnovnih komponent (angl. Principal Component Analysis; PCA) bodisi na teoriji grafov (angl. Graph Theory) 3 4 5.
Analitične metode slik možganov FDG PET na osnovi PCA se uporabljajo že vse od poznih 90. let 20. stoletja in z njimi identificirana presnovna omrežja nevrodegenerativnih bolezni so dobro validirana in klinično opredeljena na množici različnih populacij z vsega sveta. V zadnjih letih pa je napredek analitičnih modelov pripomogel k natančnejšemu vpogledu v strukturo teh omrežij 4 in omogočil identifikacijo sorodnih omrežij na osnovi slik rs-fMRI 6. Na podlagi slik rs-fMRI si prikažemo prehodna nihanja oksigenacije krvi v posameznih predelih možganov, ki so zaradi nevrovaskularne sklopitve (angl. Neurovascular Coupling) tesno povezana z nevronsko aktivnostjo in posredno prikažejo podoben rezultat kot slikanje možganske presnove s FDG PET. Pri slikanju z rs-fMRI ne potrebujemo radioaktivnega sevalca, zaradi česar je ta preiskava cenejša in dostopnejša. V nasprotju s FDG PET rs-fMRI slike prikažejo štiridimenzionalne podatke z dodatno časovno komponento, kar zahteva nekoliko spremenjen analitični pristop. Pri identifikaciji rs-fMRI omrežij so se tako izkazali kot najbolj uporabni algoritmi na osnovi analize neodvisnih komponent (angl. Independent Component Analysis; ICA).
Poleg prepoznave med seboj povezanih predelov možganov, imajo mrežni pristopi analize funkcijskih možganskih slik tudi dodatno klinično vrednost. Izraženost določenega omrežja pri posameznem preiskovancu lahko namreč prospektivno izračunamo s slik FDG PET ali rs-fMRI 3. Rezultate takšne analize, t. i. izraženost določenega omrežja, je mogoče uporabiti pri posameznem preiskovancu v kliničnem in raziskovalnem okolju za diferencialno diagnozo, prognozo ali spremljanje odziva na zdravljenje.
Funkcijska slikanja možganov so v zadnjih petih letih dobila velik zagon. Nedavni napredek na področju mrežne analize funkcijskih slikanj možganov natančneje opisujemo v nedavnem preglednem članku v februarski številki revije Nature Reviews Neurology 7.
Funkcijska omrežja pri Parkinsonovi bolezni in sorodnih sindromih
Parkinsonova bolezen (PB) je nevrodegenerativno obolenje, ki ga patološko označuje kopičenje α-sinukleina v obliki Lewyjevih telesc. Za bolezen je značilno stereotipno širjenje patoloških sprememb. Nabiranje α-sinkuleina se začne v podaljšani hrbtenjači in ponsu, čemur sledi pojav sprememb v mezencefalonu vključno s substanco nigro, v napredujoči fazi gre tudi za prizadetost možganske skorje 8. Klinične značilnosti PB korelirajo s patološkim sosledjem kot tudi s spremembami funkcijskih nevronskih omrežij. Motorično omrežje Parkinsonove bolezni (angl. Parkinson’s Disease-Related Pattern; PDRP) namreč korelira z bornim gibanjem (akinezo) in povišanim mišičnim tonusom (rigidnostjo), medtem ko kognitivno omrežje Parkinsonove bolezni (angl. Parkinson’s Disease Cognitive Pattern; PDCP) korelira s kognitivnim upadom. Obe omrežji sta bila identificirani in validirani na številnih kohortah z vsega sveta tako na podlagi slik možganov FDG PET kot tudi rs-fMRI 7.
PDRP topografsko vključuje povečano aktivnost v bazalnih ganglijih, talamusu in malih možganih skupaj z zmanjšano aktivnostjo v premotornih in posteriornih parietalnih področjih. Njegovo aktivnost je mogoče modulirati s simptomatskim zdravljenjem, ki izboljša motorične simptome. Nekaj let po pojavu PDRP se z značilnim zamikom pojavijo spremembe v kognitivnem omrežju (PDCP), ki topografsko zajemajo predvsem ventralni del omrežja privzetega stanja (angl. default mode network; DMN) z dodatnimi območji možganske skorje, kot sta dorsolateralna prefrontalna in medialna senčna skorja. Časovno sosledje izraženosti PDRP in PDCP je stereotipno in skladno z zgoraj opisanim patološkim sosledjem 9.
Akineza in rigidnost se ne pojavlja le pri PB, temveč tudi pri drugih, redkejših nevrodegenerativnih sindromih. Atipični parkinsonizmi, kot je npr. multipla sistemska atrofija (MSA) ali progresivna supranuklearna pareza (PSP), imajo drugačne patofiziološke mehanizme in sosledje patoloških sprememb. Za te sindrome so značilna druga za bolezen specifična omrežja. Pomembna značilnost mrežne analize funkcijskih slik možganov je, da lahko na posamezni sliki izračunamo izraženost mnogih patoloških omrežij, npr. pri bolniku z neopredeljenim parkinsonizmom lahko poleg izraženosti PDRP izračunamo tudi izraženost omrežij, značilnih za MSA in PSP. Na podlagi izraženosti več omrežij pa lahko s pomočjo računalniških algoritmov pomembno izboljšamo natančnost diagnoze že v zgodnjem poteku bolezni 10.
Z namenom zgodnje diagnoze se vse več raziskav PB usmerja v prodromalno fazo bolezni, tj. obdobje pred pojavom motenj gibanja, ko so v ospredju nespecifične težave, kot so motnje voha, zaprtost, depresija in vedenjska motnja faze spanja REM (angl. REM Sleep Behaviour Disorder; RBD). Bolniki z RBD običajno napredujejo v PB ali drugo α-sinukleinopatijo. Raziskave funkcijskih možganskih sprememb pri teh bolnikih so razkrile, da je PDRP izražen že v prodromalni fazi. PDRP in sorodna omrežja so tako potencialen presimptomatski biološki označevalec PB.
Vpliv zdravljenj na funkcijska omrežja
Učinkovite simptomatske metode zdravljenja PB, bodisi dopaminergična zdravila ali kirurške tehnike, kot je globoka možganska stimulacija, znižajo izraženost PDRP 7. Objektivna opredelitev sprememb v možganih na nivoju omrežij ima potencialno pomembno vlogo pri opredelitvi učinkovitosti novejših metod zdravljenja, ki spreminjajo potek bolezni. Z naprednimi analitičnimi metodami, kot je npr. teorija grafov, lahko preučujemo ne le izraženost omrežja temveč tudi spremembe v strukturi omrežja. Na ta način lahko ocenjujemo spremembe v pretoku informacij znotraj omrežja in druge mere povezljivosti 11 12 13. S tovrstnimi metodami so bile nedavno dokazane specifične spremembe v organizaciji omrežja ob genetskem zdravljenju PB z aplikacijo AAV2-GAD v subtalamična jedra in učinek zdravila, ki vpliva na mitohondrijsko dihalno funkcijo.
Funkcijska omrežja pri demenci
Podobno kot pri parkinsonizmih so tudi za nevrodegenerativne bolezni, ki se izrazijo s kognitivnim upadom, značilna za bolezen specifična funkcijska omrežja. Omrežja, značilna za Alzheimerjevo bolezen (ADRP), demenco z Lewyjevimi telesci (DLBRP), vedênjsko različico frontotemporalne demence (bvFTDRP) in nedavno identificirano omrežje, značilno za Creutzfeldt-Jakobovo bolezen (CJDRP), se med seboj ločijo v specifični topografski razporeditvi sprememb v možganski aktivnosti 7 14. Med omenjenimi kognitivnimi omrežji je najbolj raziskano ADRP, ki topografsko vključuje področja relativno znižane presnovne aktivnosti v temporoparietalnih predelih skorje, posteriornem cingulumu in prekuneusu in področja relativno zvišane presnovne aktivnosti v malih možganih. Izraženost ADRP korelira s trenutnim kognitivnim stanjem tako pri bolnikih v napredovali kot zgodnji demenci, njegova topografija pa je bila prikazana že na več neodvisnih populacijah. Nedavne študije so proučevale tudi uporabo izraženosti AD-vzorca za napovedovanje konverzije iz blage kognitivne motnje v demence in pokazale, da lahko ADRP služi kot natančen biološki označevalec napredovanja kognitivnega upada. Podobno kot pri parkinsonizmih nam tudi pri kognitivnih sindromih pri zgodnji diagnozi lahko pomaga diferencialno diagnostični algoritem, ki temelji na podlagi izraženosti kombinacije več kognitivnih omrežij 15. Natančnejši vpogled v strukturo omrežja nam omogoča razložiti klinične značilnosti, ki izhajajo iz fragmentacije in reorganizacije omrežja, kar smo nedavno dokazali pri bvFTDRP in CJDRP 7 14.
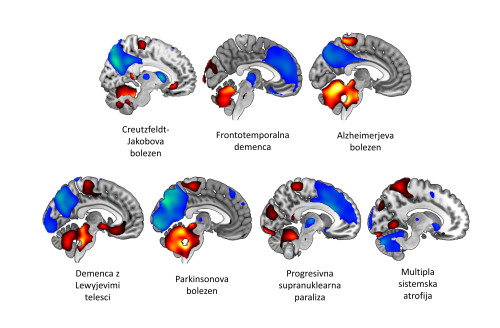
Slika 2. Presnovni možganski vzorci pri različnih nevrodegenerativnih obolenjih. Z modro so označena področja z nižjo presnovno aktivnostjo z rdečo pa povezana področja z relativno višjo oziroma ohranjeno presnovno aktivnostjo.
Sklep
Razcvet raziskav funkcionalnih omrežij pri nevrodegenerativnih boleznih v zadnjih letih je privedel do razvoja robustnih bioloških označevalcev, ki so bili potrjeni na mnogih kliničnih populacijah z različnimi slikovnimi metodami. Osebne vrednosti, tj. izraženost določenega vzorca, pa lahko že dandanes uporabimo za diagnostično in diferencialno diagnostične namene, prognozo, sledenju napredovanja bolezni in, sčasoma, sledenju učinka novih zdravil, ki bi posegale v potek bolezni. Naslednji izziv bo testiranje v realnem kliničnem okolju in identifikacija presnovnih vzorcev tudi iz slik rs-fMRI. Poleg tega bodo v prihodnosti pomembne dodatne študije, ki bodo testirale napovedno vrednost za napredovanje bolezni. Vseeno pa analitični napredek in veliko število študij kaže, da je uporaba funkcijskih možganskih omrežij v rutinski diagnostiki in kliničnih raziskavah le še (analitični) korak stran.
-
___
-
Guedj E, Varrone A, Boellaard R, et al. EANM procedure guidelines for brain PET imaging using [18F]FDG, version 3. Eur J Nucl Med Mol Imaging. 2022;49(2):632. doi:10.1007/S00259-021-05603-W ↩
-
Friston KJ, Ashburner J, Kiebel S, Nichols T, Penny WD. Statistical Parametric Mapping : The Analysis of Funtional Brain Images. Elsevier/Academic Press; 2007. ↩
-
Spetsieris PG, Eidelberg D. Scaled subprofile modeling of resting state imaging data in Parkinson’s disease: Methodological issues. Neuroimage. 2011;54(4):2899-2914. doi:10.1016/j.neuroimage.2010.10.025 ↩
-
Ko JH, Spetsieris PG, Eidelberg D. Network Structure and Function in Parkinson’s Disease. Cerebral Cortex. 2018;28(12):4121-4135. doi:10.1093/cercor/bhx267 ↩
-
Agosta F, Sala S, Valsasina P, et al. Brain network connectivity assessed using graph theory in frontotemporal dementia. Neurology. 2013;81(2):134-143. doi:10.1212/WNL.0B013E31829A33F8 ↩
-
Vo A, Sako W, Fujita K, et al. Parkinson’s disease-related network topographies characterized with resting state functional MRI. Hum Brain Mapp. 2017;38(2):617-630. ↩
-
Perovnik M, Rus T, Schindlbeck KA, Eidelberg D. Functional brain networks in the evaluation of patients with neurodegenerative disorders. Nat Rev Neurol. 2023;19(2). doi:10.1038/S41582-022-00753-3 ↩
-
Braak H, Tredici K del, Rüb U, de Vos RAI, Jansen Steur ENH, Braak E. Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiol Aging. 2003;24(2):197-211. doi:10.1016/S0197-4580(02)00065-9 ↩
-
Rus T, Schindlbeck K, Tang C, et al. Stereotyped relationship between motor and cognitive metabolic networks in Parkinson’s disease. Movement Disorders. Published online 2022. ↩
-
Tang CC, Poston KL, Eckert T, et al. Differential diagnosis of parkinsonism: a metabolic imaging study using pattern analysis. Lancet Neurol. 2010;9(2):149-158. doi:10.1016/S1474-4422(10)70002-8 ↩
-
Steen M van. Graph Theory and Complex Networks : An Introduction. Maarten van Steen; 2010. ↩
-
Vo A, Schindlbeck KA, Nguyen N, et al. Adaptive and pathological connectivity responses in Parkinson’s disease brain networks. Cerebral Cortex. Published online March 2022. doi:10.1093/cercor/bhac110 ↩
-
Niethammer M, Tang CC, Vo A, et al. Gene therapy reduces Parkinson’s disease symptoms by reorganizing functional brain connectivity. Sci Transl Med. 2018;10(469):eaau0713. doi:10.1126/scitranslmed.aau0713 ↩
-
Rus T, Mlakar J, Ležaić L, et al. Sporadic Creutzfeldt-Jakob disease is associated with reorganization of metabolic connectivity in a pathological brain network. Eur J Neurol. Published online 2022. doi:10.1111/ENE.15669 ↩
-
Perovnik M, Vo A, Nguyen N, et al. Automated differential diagnosis of dementia syndromes using FDG PET and machine learning. Front Aging Neurosci. 2022;14. doi:10.3389/FNAGI.2022.1005731 ↩
asist. Tomaž Rus, dr. med.
UKC Ljubljana
in
Matej Perovnik, dr. med.
UKC Ljubljana
