Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Primerjava učinkovitosti deksmedetomidina in melatonina za indukcijo spanja pred EEG preiskavo pri otrocih
letnik 2024, številka 26
(v pripravi)
članki
Naravno okolje kot vir zdravja in blagostanja
Karin Križman, Grega Repovš, Gaja Zager Kocjan, Gregor Geršak
Katja Peganc Nunčič, Damjan Osredkar
kolofon
letnik 2024, številka 26
S pomočjo elektroencefalografije (EEG) lahko pridobimo pomembne informacije o funkcioniranju in stanju možganov. Rutinski EEG se izvaja v budnosti, ta pa nam v določenih primerih da premalo informacij. EEG v spanju poveča možnost za odkritje epileptiformne aktivnosti, saj se ta pogosto pojavlja v povezavi s spanjem 1. Pri otrocih večkrat ni mogoče doseči spontanega spanja med EEG snemanjem, zato si v teh primerih pomagamo z zdravili za indukcijo spanja.
Otroštvo je ključno razvojno obdobje in bolezni v tem času lahko znatno ogrozijo normalni razvoj možganov, zato je zelo pomembno, da kakršno koli bolezensko dogajanje odkrijemo čim prej. S pomočjo elektroencefalografije (EEG) lahko relativno enostavno in hitro pridobimo pomembne podatke o delovanju možganov, zato je to relevantna diagnostična metoda pri otrocih z epilepsijo ter tudi pri drugih nevroloških stanjih in diagnozah, na primer po možganski kapi, poškodbah možganov, pri razvojnih motnjah itd.
Rutinska snemanja EEG v budnosti nam v nekaterih primerih dajo dovolj želenih informacij, pogosto pa je treba možgansko aktivnost posneti tudi v spanju, ker se epileptiformni izbruhi včasih pojavljajo zgolj v spanju ali na prehodu v spanec in iz njega. Poleg tega nam spanje odkriva pomembne informacije o osnovni možganski električni aktivnosti 123. EEG lahko snemamo v spontanem spanju ali v spanju, induciranem z zdravili. Za indukcijo spanja je mogoče uporabiti različne farmakološke učinkovine, od katerih se na Kliničnem oddelku za otroško, mladostniško in razvojno nevrologijo (KOOMRN) Pediatrične klinike Univerzitetnega kliničnega centra v Ljubljani pretežno uporabljata melatonin in deksmedetomidin.
MELATONIN IN DEKSMEDETOMIDIN
Melatonin je človeku lasten hormon, ki se proizvaja v epifizi iz triptofana 4. Vpliva na regulacijo poti hipotalamus–hipofiza–gonada, uravnava cirkardiane ritme, sproščanje hormonov, telesno temperaturo idr. 5 Kadar je uporabljen eksogeno, gre za analog naravnega melatonina, ki inducira naraven spanec. 2 6
Deksmedetomidin je specifični agonist alfa-2 adrenergičnih receptorjev v možganskem jedru locus coeruleus, ki aktivira endogene poti za spanje z zmanjšanjem nevralne noradrenargične aktivnosti in posledično spodbudi aktivacijo zaviralnih nevronov ter tako doseže sedacijo. 7 8
UČINKOVITOST
V letošnjem letu je bila objavljena raziskava, ki primerja ti dve učinkovini po učinkovitosti in varnosti. 9 V študijo je bilo vključenih 156 otrok, starih od enega do devetnajst let, ki so bili hospitalizirani na KOOMRN in napoteni na EEG v spanju. Z žrebom so bili naključno določeni v skupino: v prvi je bil za indukcijo spanja uporabljen melatonin (Mel), apliciran oralno 54 udeležencem v dozi 0,1 mg/kg; v drugi deksmedetomidin, uporabljen sublingvalno (DS) pri 51 udeležencih, in v tretji deksmedetomidin, apliciran intranazalno (DN) prav tako pri 51 udeležencih, v obeh primerih v dozi 3 mcg/kg. Če 30 minut po aplikaciji preiskovanec ni dosegel vsaj prve faze spanja, je ponovno potekal žreb za uporabo drugega zdravila, pri čemer je veljalo pravilo: če je preiskovanec kot prvo zdravilo prejel melatonin, je drugič prejel deksmedetomidin – in obratno. Primerjave so bile narejene tudi za podskupino otrok s kompleksnimi vedenjskimi težavami.
V raziskavi je 99,4 odstotka preiskovancev uspešno zaspalo, 93,6 odstotka že po prvi aplikaciji. Po melatoninu je zaspalo 83,3 odstotka sodelujočih, po sublingvalni aplikaciji deksmedetomidina ni zaspal le en udeleženec, v skupini DN pa so zaspali vsi. Deksmedetomidin je bil po prvi aplikaciji učinkovitejši od Mel, tudi pri pacientih s kompleksnimi vedenjskimi težavami, in to celo v 100 odstotkih, Mel pa le v 73,4 odstotka. Do sedaj še ni bilo študije, ki bi primerjala ti dve zdravili, je pa sam odstotek učinkovitosti dosega spanja po melatoninu podoben tudi v drugih študijah (med 70 in 83 odstotki) 10 11 12 13 14, medtem ko je bil deksmedetomidin v drugih študijah povprečno manj učinkovit kot v tej (v 87 odstotkih do 92,2 odstotka). 15 16 17
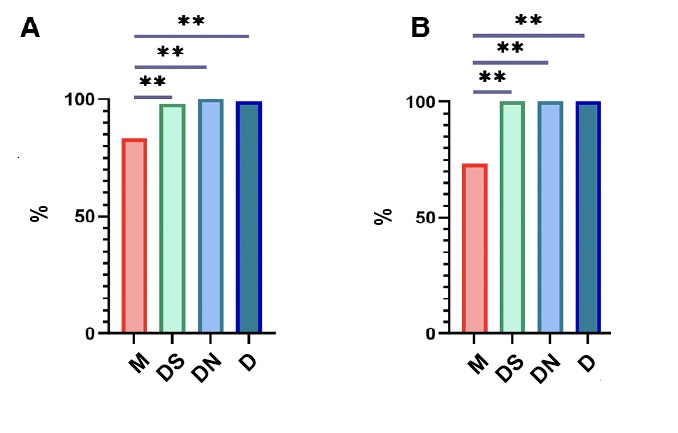
~Slika 1: Delež uspešno doseženega spanja pri preiskovancih glede na prvo prejeto zdravilo. (A) Uspešnost dosega spanja pri vseh udeležencih. (B) Uspešnost dosega spanja pri otrocih s kompleksnimi vedenjskimi težavami.
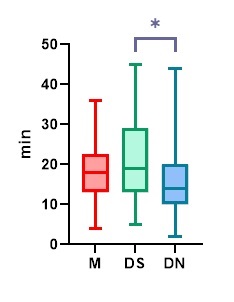
Povprečno so preiskovanci zaspali po 18,1 minute (min) po prvi aplikaciji zdravila in 15,9 min po drugi aplikaciji, če je bila potrebna. Ob primerjavi skupin po prvi aplikaciji, ki je prikazana na grafu 1, vidimo, da so v skupini Mel otroci povprečno zaspali po 17,3 min, v skupini DS po 20,6 min in v DN po 15,7 min. Tudi v študiji, ki je primerjala intranazalno in sublingvalno aplikacijo deksmedetomidina, so ugotovili, da je bila intranazalna aplikacija učinkovitejša, saj je pri nesodelujočih otrocih težko doseči, da zdravilo pod jezikom zadržijo dovolj časa, da se omogoči dobra absorpcija. 18 V podskupini otrok s kompleksnimi vedenjskimi težavami ni bilo zaznanih pomembnih razlik med skupinami glede časa uspavanja.
VARNOST
Poleg uspešnosti je raziskava preverjala tudi varnost na podlagi izmerjenih vitalnih znakov. Spremljani so bili: srčna frekvenca, frekvenca dihanja, saturacija in krvni tlak. Ugotovljeno je bilo, da pri nikomer v študiji ni prišlo do respiratorne depresije, bradikardije, desaturacije ali hipotenzije, kar dokazuje, da sta obe učinkovini varni za uporabo.
ZAKLJUČEK
Študija je pokazala, da sta tako melatonin kot deksmedetomidin varna za uspavanje otrok pred EEG v spanju. Pri neučinkovitosti enega zdravila je smiselno dodati še drugo. Za deksmedetomidin (predvsem če je apliciran intranazalno) pa lahko rečemo, da je učinkovitejši za dosego spanja kot melatonin, še posebej pri otrocih s kompleksnimi vedenjskimi težavami.
-
___
-
Kothare SV, Kaleyias J. Sleep and epilepsy in children and adolescents. Sleep Med. 2010;11(7):674–685. doi:10.1016/j.sleep.2010.01.012 ↩
-
Dirani M, Nasreddine W, Melhem J, Arabi M, Beydoun A. Efficacy of the Sequential Administration of Melatonin, Hydroxyzine, and Chloral Hydrate for Recording Sleep EEGs in Children. Clin EEG Neurosci. 2017;48(1):41–47. doi:10.1177/1550059415621830 ↩
-
Malow BA. The interaction between sleep and epilepsy. Epilepsia. 2007;48(SUPPL. 9):36-38. doi:10.1111/j.1528-1167.2007.01400.x ↩
-
Brzezinski A, Vangel MG, Wurtman RJ, et al. Effects of exogenous melatonin on sleep: A meta-analysis. Sleep Med Rev. 2005;9(1):41–50. doi:10.1016/j.smrv.2004.06.004 ↩
-
Cavallo A. The pineal gland in human beings: Relevance to pediatrics. J Pediatr. 1993;123(6):843–851. doi:10.1016/S0022-3476(05)80377-4 ↩
-
Wassmer E, Carter PFB, Quinn E, et al. Melatonin is useful for recording sleep EEGs: A prospective audit of outcome. Dev Med Child Neurol. 2001;43(11):735–738. doi:10.1111/j.1469-8749.2001.tb00153.x ↩
-
Nelson LE, Lu J, Guo T, Saper CB, Franks NP, Maze M. The α2-adrenoceptor agonist dexmedetomidine converges on an endogenous sleep-promoting pathway to exert its sedative effects. Anesthesiology. 2003;98(2):428–436. doi:10.1097/00000542-200302000-00024 ↩
-
Weerink MAS, Struys MMRF, Hannivoort LN, Barends CRM, Absalom AR, Colin P. Clinical Pharmacokinetics and Pharmacodynamics of Dexmedetomidine. Clin Pharmacokinet. 2017;56(8):893–913. doi:10.1007/s40262-017-0507-7 ↩
-
Peganc Nunčič K, Neubauer D, Oražem Mrak J, et al. Melatonin vs. dexmedetomidine for sleep induction in children before electroencephalography. Front Pediatr. 2024;12. doi:10.3389/fped.2024.1362918 ↩
-
Chen H, Yang F, Ye M, et al. Intranasal dexmedetomidine is an effective sedative agent for electroencephalography in children. BMC Anesthesiol. 2020;20(1):1–5. doi:10.1186/s12871-020-00978-z ↩
-
Ray T, Tobias JD. Dexmedetomidine for sedation during electroencephalographic analysis in children with autism, pervasive developmental disorders, and seizure disorders. J Clin Anesth. 2008;20(5):364–368. doi:10.1016/j.jclinane.2008.03.004 ↩
-
Mason KP, Lubisch N, Robinson F, Roskos R, Epstein MA. Intramuscular dexmedetomidine: An effective route of sedation preserves background activity for pediatric electroencephalograms. J Pediatr. 2012;161(5):927–932.e2. doi:10.1016/j.jpeds.2012.05.011 ↩
-
Berkenbosch JW. Options and Considerations for Procedural Sedation in Pediatric Imaging. Pediatr Drugs. 2015;17(5):385–399. doi:10.1007/s40272-015-0140-6 ↩
-
Fernandes ML, De Oliveira WM, Santos MDCV, Gomez RS. Sedation for electroencephalography with dexmedetomidine or chloral hydrate: A comparative study on the qualitative and quantitative electroencephalogram pattern. J Neurosurg Anesthesiol. 2015;27(1):21–25. doi:10.1097/ANA.0000000000000077 ↩
-
Gumus H, Bayram AK, Poyrazoglu HG, et al. Comparison of Effects of Different Dexmedetomidine and Chloral Hydrate Doses Used in Sedation on Electroencephalography in Pediatric Patients. J Child Neurol. 2015;30(8):983–988. doi:10.1177/0883073814549582 ↩
-
Li BL, Ni J, Huang JX, Zhang N, Song XR, Yuen VM. Intranasal dexmedetomidine for sedation in children undergoing transthoracic echocardiography study – A prospective observational study. Paediatr Anaesth. 2015;25(9):891–896. doi:10.1111/pan.12687 ↩
-
Baier NM, Mendez SS, Kimm D, Velazquez AE, Schroeder AR. Intranasal dexmedetomidine: An effective sedative agent for electroencephalogram and auditory brain response testing. Paediatr Anaesth. 2016;26(3):280–285. doi:10.1111/pan.12851 ↩
-
Cimen ZS, Hanci A, Sivrikaya GU, Kilinc LT, Erol MK. Comparison of buccal and nasal dexmedetomidine premedication for pediatric patients. Paediatr Anaesth. 2013;23(2):134–138. doi:10.1111/pan.12025 ↩
Katja Peganc Nunčič, dipl. del. ter., mag. kog. zn.
Izr. prof. dr. Damjan Osredkar, dr. med.
Oddelek za otroško, mladostniško in razvojno nevrologijo, Pediatrična klinika, UKC Ljubljana
Sprejeto: 27.06.2024
Objavljeno: 08.07.2024