Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Ocena integritete dopaminergičnega sistema v diagnostiki parkinsonizmov
letnik 2024, številka 26
uvodnik
Od narave do nevronov: nova dognanja v nevroznanosti za boljše zdravje in razumevanje možganov
Maša Čater
članki
Naravno okolje kot vir zdravja in blagostanja
Karin Križman, Grega Repovš, Gaja Zager Kocjan, Gregor Geršak
Katja Peganc Nunčič, Damjan Osredkar
Tanja Goltnik
Ali je zgodnje vstajanje dedno?
Cene Skubic, Laura Plavc, Damjana Rozman, Leja Dolenc Grošelj
kolofon
letnik 2024, številka 26
Parkinsonizmi so skupina bolezni, ki se klinično izrazijo z bornostjo gibanja (bradihipokinezo), okorelostjo mišic (rigidnostjo) in tremorjem 1. Najpogostejši vzrok parkinsonizma so nevrodegenerativne bolezni, kot je Parkinsonova bolezen (PB), lahko pa se pojavi tudi pri drugih stanjih, ki okvarijo kortiko-striato-talamo-kortikalno nevronsko zanko. Sindrom parkinsonizma lahko povzročijo zdravila, ki blokirajo dopaminske receptorje, kot so npr. antipsihotiki, ter vaskularne in druge lezije, ki okvarijo kortiko-striato-talamo-kortikalno zanko ali nigrostriatne povezave. Metode, s katerimi lahko preučujemo okvare omenjenih nevronskih omrežij, uporabljamo ne le v raziskavah parkinsonizmov, temveč tudi v rutinski obravnavi teh bolezni 2 (več v prispevku Rus in Perovnik). Klinično še posebej pomembne so preiskave dopaminergičnega sistema z nuklearno-medicinskimi metodami, ki nevrologu omogočajo natančno in zanesljivo diagnozo ter ga usmerijo pri zdravljenju parkinsonizmov.
Bazalni gangliji so skupek jeder, ki se nahajajo v globini hemisfer velikih možganov in sodelujejo v kompleksnem omrežju, ki uravnava gibanje. Patološki procesi, ki okvarijo posamezne podsisteme bazalnih ganglijev, se kažejo bodisi z bornostjo gibanja (hipokinetične motnje gibanja; parkinsonizmi) bodisi kot nenadzorovani in prekomerni gibi (hiperkinetične motnje) 3. V tem kompleksnem sistemu, ki obsega možgansko skorjo, striatum, globus pallidus, talamus in subtalamično jedro, ima še posebej pomembno vlogo kompaktni del črne substance v mezencefalonu (lat. substanca nigra pars compacta) in nigrostriatne povezave, ki črno substanco povezujejo z bazalnimi gangliji.
Pri PB, najpogostejšem nevrodegenerativnem parkinsonizmu, se patološka beljakovina α-sinuklein v obliki Lewyjevih telesc stereotipno širi iz podaljšane hrbtenjače preko mezencefalona, bazalnega prozencefalona v mezokorteks in na koncu doseže neokorteks 4. Ko patološki proces prizadene mezencefalon in okvari dopaminergične nevrone črne substance, se to klinično izrazi z znaki parkinsonizma. Dopaminergične nigrostriatne povezave namreč igrajo pomembno vlogo pri modulaciji kortiko-striato-talamo-kortikalne zanke in s tem gibanja 3.
Dopaminergični sistem v bazalnih ganglijih
Dopaminergični sistem v bazalnih ganglijih sestavljata presinaptični del, ki ga tvorijo dopaminergični nevroni, projicirani iz črne substance v striatum, in postsinaptični del, ki ga predstavljajo striatalni nevroni. Presinaptični in postsinaptični nevroni se razlikujejo po svoji molekularni sestavi, kar izkoriščamo pri oceni integritete tega sistema z molekularnim slikanjem (Slika 1). Pri molekularnem slikanju uporabljamo radioaktivno označene molekule (radiofarmake), ki se vežejo na tarčne molekule v celici in oddajajo bodisi pozitrone bodisi gama žarke, ki jih zaznamo s kamerami PET (pozitronska emisijska tomografija) ali SPECT (ang. single photon emission computed tomography; enofotonska emisijska računalniška tomografija).
Presinaptično dopaminergično integriteto lahko preučujemo na ravni sinteze dopamina z uporabo 18F-FDOPA PET, fluorirane oblike L-DOPA. Shranjevanje dopamina lahko ocenjujemo z uporabo radiofarmakov, ki se vežejo na vezikularne monoaminske transporterje 2 (VMAT2), odgovorne za privzem monoaminov iz citoplazme v sekrecijske vezikle v dopaminergičnih nevronih. Najpogosteje uporabljena tehnika pa je ocena ponovnega privzema dopamina v presinaptične nevrone z uporabo 123I-ioflupan SPECT (DaTSCAN™) oz. scintigrafijo dopaminskega prenašalca. 123I-ioflupan se specifično veže na dopaminske transporterje (DAT) na presinaptični membrani. Relativno dolga razpolovna doba 123I omogoča transport te spojine v oddaljene zdravstvene centre in s tem rutinsko uporabo v kliničnih okoljih (radiofarmake, označene s kratkoživimi radioizotopi, kot sta npr. 11C ali 15O, lahko zaradi hitrega razpada uporabimo le v bližini proizvodnje).
Okvaro postsinaptičnega nevrona lahko proučujemo z radiofarmaki, ki se vežejo na dopaminske receptorje (D2 receptorje). Zaradi omejene razpoložljivosti teh spojin in slabše diagnostične vrednosti jih uporabljamo le redko in predvsem v raziskovalne namene.
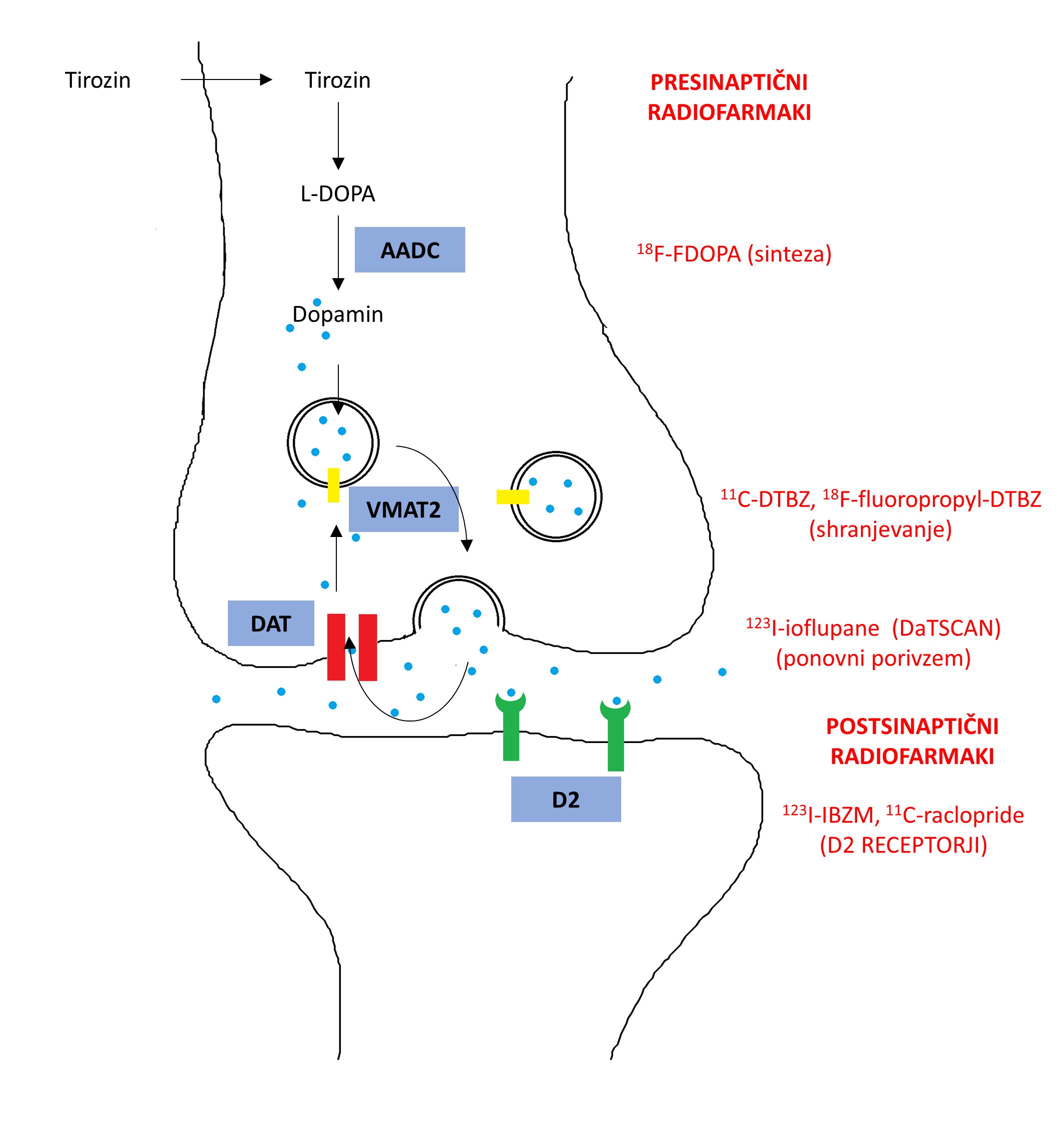
Slika 1. Shematski prikaz poenostavljene sinapse v striatumu s tarčnimi molekulami molekularnega slikanja (označeno z modrimi kvadrati) in radiofarmaki, ki se vežejo nanje (označeno z rdečim besedilom). AADC – aromatična L-amino kislinska dekarboksilaza, VMAT2 – vezikularni monoaminski prenašalec 2, DAT – dopaminski prenašalec, D2 – D2 receptor, 18F-FDOPA – 18F-fluorodopa, 11C-DTBZ – 11C-dihidrotetrabenazin, 123I-IBZM – 123I-jodobenzamid.
Integriteta dopaminergičnega sistema pri nevrodegenerativnih parkinsonizmih
Okvara dopaminergičnih nevronov v črni substanci se pri PB začne pred prvimi znaki parkinsonizma. Ob postavitvi diagnoze je količina dopaminergičnih nevronov že zmanjšana za 50 odstotkov, v nadaljnjem poteku bolezni pa nevroni postopno linearno propadajo 5. Scintigrafija dopaminskega prenašalca z 123I-ioflupanom že v zgodnji PB razkrije zmanjšano kopičenje radiofarmaka, ki napreduje v kavdo-rostralni smeri (Slika 2). Sprva zaznavamo znižano kopičenje v posteriornih delih putamnov. Skladno s klinično sliko, je izpad kopičenja asimetričen, izrazitejši na strani kontralateralno od bolj prizadetih okončin (Slika 2C) 6. Sčasoma presinaptična dopaminergična okvara napreduje; kopičenje radiofarmaka je pri napredovali bolezni v putamnih odsotno, v kavdatnih jedrih pa izrazito in asimetrično znižano, vendar še zaznavno (Slika 2D) 5.
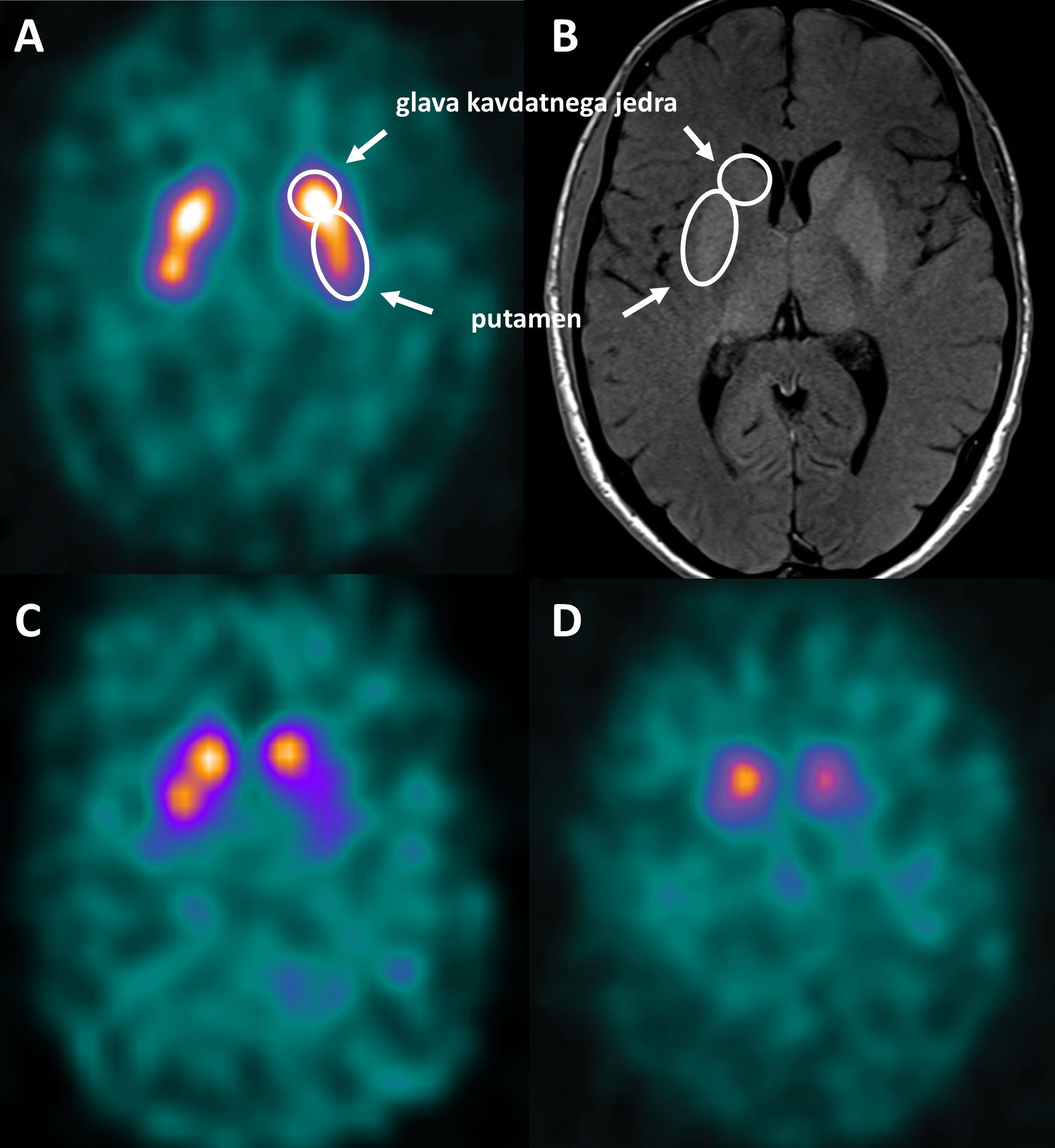
Slika 2. Scintigrafija dopaminskega prenašalca (DAT) z 123I-ioflupanom (DaTSCAN™). A – normalno kopičenje radiofarmaka v kavdatnih jedrih in putamnih pri bolniku z esencialnim tremorjem. B – MRI glave zdravega preiskovanca v isti ravnini (prikazan z namenom anatomske orientacije). C – asimetrično znižano kopičenje radiofarmaka pri bolniku z zgodnjo Parkinsonovo boleznijo. Izpad kopičenja je viden predvsem v levem putamnu, blago znižan v desnem putamnu in ohranjen v kavdatnih jedrih. D – izrazito znižano kopičenje radiofarmaka pri bolniku z napredovalo Parkinsonovo boleznijo. Kopičenje radiofarmaka v putamnih je odsotno, v kavdatnih jedrih pa izrazito znižano. Vir: Klinika za nuklearno medicino in Klinični inštitut za radiologijo, UKC Ljubljana.
Scintigrafija dopaminskega prenašalca je patološka tudi pri atipičnih parkinsonizmih, kot sta multipla sistemska atrofija (MSA) in progresivna supranuklearna pareza (PSP), saj presinaptični nevroni propadajo tudi pri teh boleznih. Raziskave na večjem številu bolnikov so pokazale, da je razporeditev radiofarmaka pri teh boleznih drugačna: izpad ne sledi kavdorostralni smeri in je bolj simetričen 7 8. Na ravni posameznih bolnikov je tovrstna ocena razporeditve radiofarmaka premalo specifična za zanesljivo razlikovanje med različnimi nevrodegenerativnimi parkinsonizmi 7 8. Za razlikovanje med temi boleznimi lahko uporabimo radiofarmake, ki se vežejo na D2-receptorje (Slika 1); pri PB je ta vezava ohranjena, medtem ko je pri atipičnih parkinsonizmih znižana 9. Kljub temu je slikanje dopaminskih receptorjev trenutno omejeno predvsem na raziskovalno okolje. V rutinski diagnostiki za diferencialno diagnozo uporabljamo slikanje FDG-PET, ki se je izkazalo za bolj občutljivo in specifično 2 10 11 12. FDG-PET nam omogoča vpogled v regionalno možgansko presnovo, ki je tesno povezana z lokalno sinaptično aktivnostjo. Različne nevrodegenerativne bolezni prizadenejo specifične predele možganov in s tem povezana nevronska omrežja, kar se odraža v značilnih vzorcih kopičenja radiofarmaka, specifičnih za posamezne oblike nevrodegenerativnih parkinsonizmov 2 10 12.
V rutinski diagnostiki parkinsonizmov se torej uporabljata dve nuklearno-medicinski metodi: scintigrafija dopaminskih prenašalcev (DaTSCAN™), ki omogoča razlikovanje med nevrodegenerativnimi parkinsonizmi in ne-nevrodegenerativnimi boleznimi, ter FDG-PET, ki omogoča natančno razlikovanje med različnimi vrstami nevrodegenerativnih parkinsonizmov ter tako pomaga pri določanju specifične bolezni 10.
Indikacije za scintigrafijo dopaminskih receptorjev
Scintigrafija dopaminskih transporterjev z 123I-ioflupanom (DaTSCAN™) je preiskava, ki je na voljo v rutinski klinični praksi in jo je odobrila Evropska agencija za zdravila (EMA). Kljub visoki ceni je nepogrešljiva pri diagnozi parkinsonizmov pri izbranih bolnikih, saj lahko pomembno vpliva na zdravljenje.
Nevrolog se za preiskavo odloči, ko ni mogoče klinično razlikovati med esencialnim tremorjem in PB. Preiskava izjemno natančno razlikuje med obema stanjema z diagnostično občutljivostjo in specifičnostjo do 95 odstotkov 13.
Druga indikacija omenjene preiskave je razlikovanje med nevrodegenerativnimi parkinsonizmi in iatrogenim ali vaskularnim parkinsonizmom. Dolgotrajna uporaba zdravil, ki blokirajo dopaminske receptorje, lahko povzroči spremembe v bazalnih ganglijih, ki se izrazijo kot parkinsonizem. Pri iatrogenem parkinsonizmu je presinaptični dopaminergični sistem v nasprotju z nevrodegenerativnimi parkinsonizmi ohranjen. Scintigrafija dopaminskega prenašalca pri tej indikaciji dosega visoko specifičnost (94-odstotno) in občutljivost (86-odstotno) 14.
Preiskava je prav tako nepogrešljiva pri razlikovanju med nevrodegenerativnimi parkinsonizmi in vaskularnim parkinsonizmom, čeprav je diagnostična natančnost nekoliko nižja, s 83-odstotno specifičnostjo in 86-odstotno občutljivostjo 6. Vaskularni parkinsonizem lahko nastane zaradi ishemičnih sprememb, ki prizadenejo omrežja, pomembna za nadzor gibanja. Te spremembe najpogosteje prizadenejo belo možganovino in okvarijo kortiko-striato-talamo-kortikalne povezave. V takih primerih je presinaptična dopaminergična integriteta ohranjena, zato je scintigrafija dopaminskega prenašalca normalna.
Če pa vaskularne spremembe, kot so lakunarne ishemične možganske kapi, prizadenejo striatum, črno substanco ali nigrostriatne povezave, je lahko izvid patološki. Kljub temu nam lahko tak izvid pomaga pri diagnozi, saj je razporeditev izpada kopičenja radiofarmaka drugačna kot pri PB. Pri vaskularnem parkinsonizmu ne pričakujemo kavdorostralne okvare striatuma, temveč izpad kopičenja radiofarmaka v omejenem predelu bazalnih ganglijev, z ohranjenim kopičenjem v posteriornem putamnu 15. Tovrsten izvid je še posebej pomemben, saj raziskave kažejo, da imajo bolniki z vaskularnim parkinsonizmom in nigrostriatno okvaro boljši odziv na dopaminergično terapijo kot tisti z normalno scintigrafijo dopaminskega prenašalca 15.
Scintigrafija dopaminskega prenašalca izven okvira nevrodegenerativnih parkinsonizmov
Scintigrafija dopaminskega prenašalca ni koristna samo pri nevrodegenerativnih parkinsonizmih, temveč tudi pri diagnostiki drugih, redkejših vzrokov parkinsonizmov. Podobno kot pri vaskularnem parkinsonizmu lahko ta klinični sindrom povzročijo tudi druge lezije, ki prizadenejo nevronska omrežja, vključena v nadzor gibanja.
Nedavno smo obravnavali 56-letnega moškega, ki je utrpel difuzno aksonsko možgansko poškodbo s številnimi hemoragičnimi lezijami, vključno z lezijo v področju leve črne substance (Slika 3A) 16. Kljub uspešni rehabilitaciji so vztrajale številne težave, vključno z desnostranskim parkinsonizmom. Scintigrafija dopaminskega prenašalca je razkrila hudo izgubo nigrostriatnih dopaminergičnih povezav na levi strani (Slika 3B). Kopičenje radiofarmaka je bilo v levem striatumu popolnoma odsotno, v nasprotju s PB, kjer tudi v napredovali bolezni pričakujemo ostanek kopičenja v kavdatnih jedrih. Kljub odsotnosti nevrodegenerativnega vzroka je uvedba dopaminergične terapije občutno izboljšala simptome.
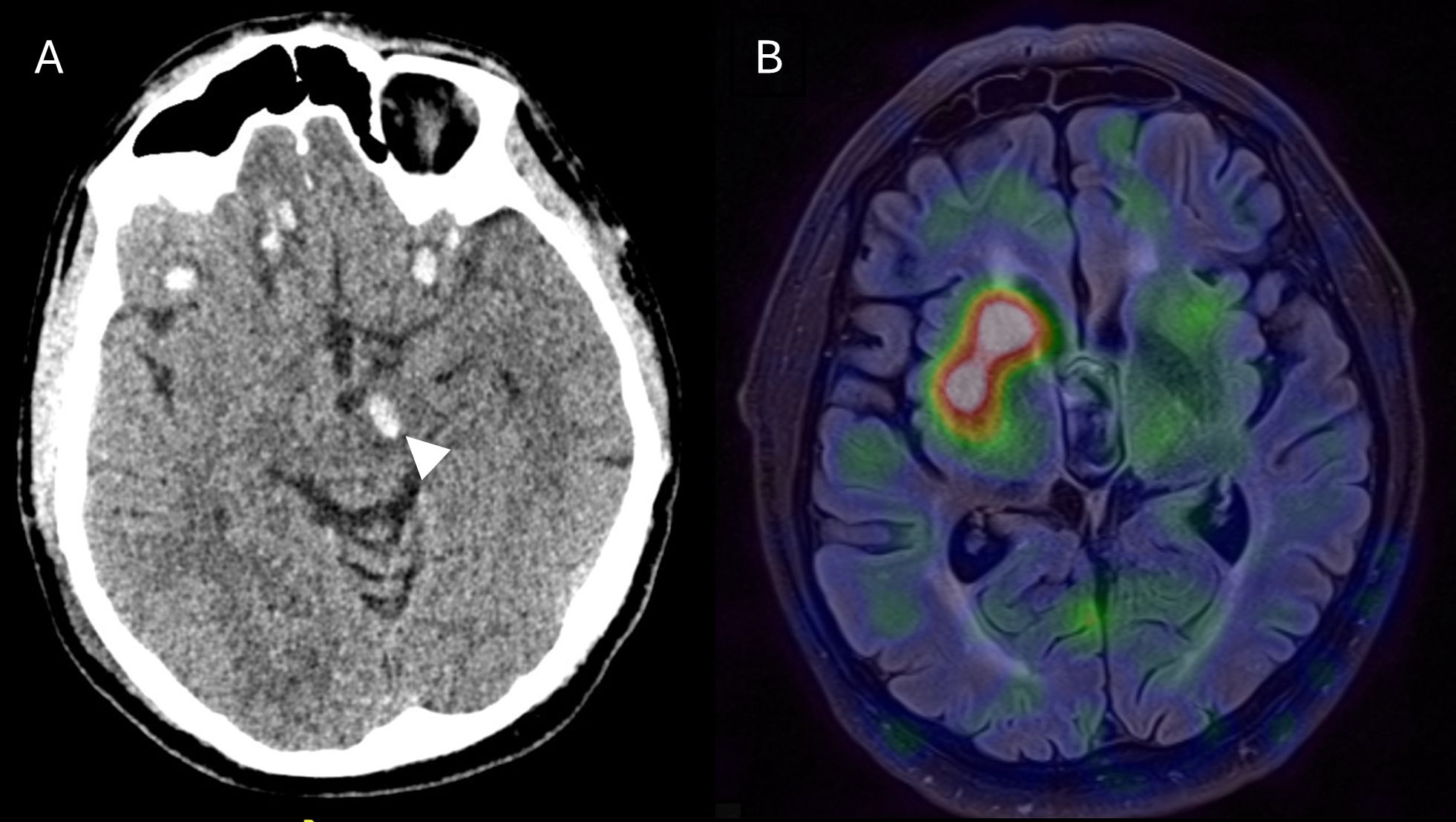
Slika 3. A – CT glave prikazuje hemoragično lezijo v področju leve črne substance po hudi difuzni aksonski poškodbi možganov. B – Scintigrafija dopaminskega prenašalca z 123I-ioflupanom (DaTSCAN™) prikazuje popolno odsotnost kopičenja radiofarmaka v levem striatumu kot posledico popolne okvare nigrostriatnih povezav. Povzeto po Rus in sodelavci 16.
Zaključek
Preiskave integritete dopaminergičnega sistema pri parkinsonizmih z metodami nuklearne medicine so nepogrešljive tako v raziskavah teh bolezni kot tudi v rutinski diagnostiki. Poleg tega, da omogočajo natančno diagnozo znotraj jasno opredeljenih kliničnih indikacij, pomembno vplivajo tudi na izbor terapije. Zaradi visokih stroškov in zapletene logistike teh preiskav sta izjemno pomembna pravilno določanje indikacij in napotitev izbranih bolnikov, pri katerih bo izvid pomembno vplival na nadaljnjo obravnavo. Nekritično napotovanje lahko vodi v nepotrebno dolge čakalne vrste in onemogoča dostop do preiskave tistim bolnikom, ki jo resnično potrebujejo.
-
___
-
Postuma RB, Berg D, Stern M, et al. MDS clinical diagnostic criteria for Parkinson’s disease. Movement Disorders. 2015;30(12):1591-1601. doi:10.1002/mds.26424 ↩
-
Rus T, Perovnik M. Možganska omrežja pri nevrodegenerativnih boleznih. eSiNAPSA. https://www.sinapsa.org/eSinapsa/stevilke/2023-24/336/Mozganska_omrezja_pri_nevrodegenerativnih_boleznih. 2024. Accessed August 26, 2024. ↩
-
Wichmann T, DeLong MR. Anatomy and physiology of the basal ganglia: relevance to Parkinson’s disease and related disorders. Handb Clin Neurol. 2007;83. doi:10.1016/S0072-9752(07)83001-6 ↩
-
Adler CH, Beach TG, Zhang N, et al. Unified staging system for Lewy body disorders: Clinicopathologic correlations and comparison to Braak staging. J Neuropathol Exp Neurol. 2019;78(10):891-899. doi:10.1093/jnen/nlz080 ↩
-
Fearnley JM, Lees AJ. Ageing and Parkinson’s disease: substantia nigra regional selectivity. Brain. 1991;114 ( Pt 5)(5):2283-2301. doi:10.1093/BRAIN/114.5.2283 ↩
-
Bega D, Kuo PH, Chalkidou A, et al. Clinical utility of DaTscan in patients with suspected Parkinsonian syndrome: a systematic review and meta-analysis. NPJ Parkinsons Dis. 2021;7(1). doi:10.1038/S41531-021-00185-8 ↩
-
AA R, P P, M P. Clinical utility of DaTscanTM (123I-Ioflupane Injection) in the diagnosis of Parkinsonian Syndromes. Degener Neurol Neuromuscul Dis. 2013;3:33. doi:10.2147/DNND.S19807 ↩
-
Ogawa T, Fujii S, Kuya K, et al. Role of Neuroimaging on Differentiation of Parkinson’s Disease and Its Related Diseases. Yonago Acta Med. 2018;61(3):145. doi:10.33160/YAM.2018.09.001 ↩
-
Schreckenberger M, Hägele S, Siessmeier T, et al. The dopamine D2 receptor ligand 18F-desmethoxyfallypride: an appropriate fluorinated PET tracer for the differential diagnosis of parkinsonism. Eur J Nucl Med Mol Imaging. 2004;31(8):1128-1135. doi:10.1007/S00259-004-1465-5 ↩
-
Rus T, Jamšek J, Berlot R, Popovič KŠ, Grmek M, Trošt M. Nuclear medicine investigations in dementia and parkinsonism. Zdravniski Vestnik. 2020;89(3-4):203-222. doi:10.6016/ZdravVestn.2935 ↩
-
Perovnik M, Rus T, Schindlbeck KA, Eidelberg D. Functional brain networks in the evaluation of patients with neurodegenerative disorders. Nat Rev Neurol. 2023;19(2). doi:10.1038/S41582-022-00753-3 ↩
-
Berti V, Pupi A, Mosconi L. PET / CT in diagnosis of movement disorders. Ann N Y Acad Sci. 2011;1228(1):93-108. doi:10.1111/j.1749-6632.2011.06025.x ↩
-
Hauser RA, Grosset DG. [123I]FP-CIT (DaTscan) SPECT Brain Imaging in Patients with Suspected Parkinsonian Syndromes. Journal of Neuroimaging. 2012;22(3):225-230. doi:10.1111/j.1552-6569.2011.00583.x ↩
-
Brigo F, Matinella A, Erro R, Tinazzi M. [123I]FP-CIT SPECT (DaTSCAN) may be a useful tool to differentiate between Parkinson’s disease and vascular or drug-induced parkinsonisms: a meta-analysis. Eur J Neurol. 2014;21(11):1369-e90. doi:10.1111/ENE.12444 ↩
-
Lee MJ, Kim SL, Kim HI, et al. [(18)F] FP-CIT PET study in parkinsonian patients with leukoaraiosis. Parkinsonism Relat Disord. 2015;21(7):704-708. doi:10.1016/J.PARKRELDIS.2015.04.007 ↩
-
Rus T, Cuderman A, Georgiev D. Parkinsonism Associated With Traumatic Hemorrhage in Substantia Nigra: Role of Presynaptic Dopaminergic Imaging. Neurology. 2024;102(9):e209384. doi:10.1212/WNL.0000000000209384 ↩
Doc. dr. Tomaž Rus, dr. med., specialist nevrologije
Klinični oddelek za bolezni živčevja, UKC Ljubljana
in
Klinika za nuklearno medicino, UKC Ljubljana
Sprejeto: 31. 7. 2024
Objavljeno: 29. 8. 2024