Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
COVID-19 in možgani
letnik 2020, številka 18
uvodnik
Maša Čater
članki
Bolezni spektra anti-MOG pri odraslih
Nik Krajnc
Samomor pod lupo nevroznanosti
Alina Holnthaner
intervjuji
Miha Pribošič
aktualno
Preplet možganov in imunskega sistema v času stresa
Dolores Trol
kolofon
letnik 2020, številka 18
Novo številko revije eSinapsa odpiramo s kratkim prispevkom o trenutno aktualni globalni problematiki, pandemiji koronavirusa SARS-CoV-2. Virus povzroča akutno dihalno obolenje, vročino, pljučnico in druge komplikacije dihalnega sistema. Znanstveniki še vedno raziskujejo naravo virusa, njegov izvor ter delovanje (slika 1). Vedno več primerov pa kaže na to, da njegovo delovanje ni omejeno zgolj na dihalni sistem. V znanstvenih revijah se pojavljajo zapisi, da lahko vpliva tudi na centralno živčevje.
Prehajanje v celice preko proteina ACE2
Večina okužb s SARS-CoV-2 poteka blago, medtem ko v nekaterih primerih le-ta povzroča resne srčno-dihalne komplikacije in pušča dolgoročne posledice na pljučih. V najtežjih primerih pa lahko okužba vodi v odpoved organov in sepso kot posledica citokinske nevihte zaradi aktivacije imunskega sistema 2. Virus SARS-CoV-2 je podoben virusu SARS-CoV. Oba si delita sposobnost primarnega vstopanja v gostiteljeve celice preko neposredne povezave s proteinom na površini epitelijskih celic 3. Gre za protein angiotenzin konvertazo 2 (ACE2; angl. angiotension converting enzyme 2). Celično prehajanje pospešuje tudi nikotinski acetilholinski receptor (nAChR), za katerega vemo, da se izraža na številnih celicah različnih organov skupaj z ACE2 4, kjer funkcionalno sodelujeta. Pri kadilcih nikotin stimulira nAChR, ta pa poveča izražanje ACE2. Raziskovalci zato predvidevajo, da so celice kadilcev dovzetnejše za okužbo s SARS-CoV-2.
So tudi možgani na udaru?
Prisotnost sorodnega virusa SARS-CoV je že bila potrjena postmortem v možganih in v možgansko-hrbtenjačni tekočini okuženih ljudi 5. V možganih se izražata tako ACE2 kot tudi nAChR, zato raziskovalci predvidevajo, da lahko tudi SARS-CoV-2 vstopa v živčni sistem 6. Vstopanje virusov SARS v nevrone preko vstopne točke ACE2 je bilo eksperimentalno potrjeno in vitro že pred desetletjem 7.
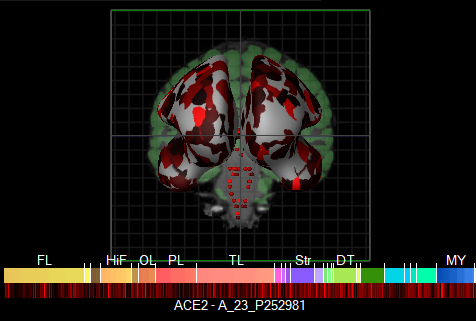
Tako kot v drugih organih, ACE2 v možganih pretvarja angiotenzin II v angiotenzin 1-7 in na ta način zmanjšuje oksidativni stres celic. Ti procesi se odvijajo v nevronih in astrocitih 8. Motnje v delovanju ACE vodijo v nevrodegeneracijo dopaminergičnih nevronov 9. Na sliki 2 so označeni možganski predeli, kjer se izraža ACE2; gre predvsem za skorjo, striatum, hipotalamus in možgansko deblo. Za te predele je znano, da se v njih izraža tudi nAChR 10, kar še podkrepi predvidevanja raziskovalcev, da so ti predeli najverjetnejša vstopna mesta za okužbo možganov s SARS-CoV-2.

Slika 2: Rdeče obarvani možganski predeli izražajo ACE2 (© 2010 Allen Institute for Brain Science. Allen Human Brain Atlas).
Nevrološki simptomi okužbe COVID-19
Virusno prehajanje krvno-možganske pregrade je verjetnejše v težjih primerih okužbe in je povezano z močnimi imunskimi odzivi, kot je citokinska nevihta. Najnovejša medicinska poročila kažejo, da nevrološke simptome izkazuje kar 36 % pacientov s COVID-19 11. Pacienti poročajo o izgubi zaznavanja vonja ali okusa, pojavljajo se miopatije in kapi kot tudi glavoboli, izgubljanje zavesti, ataksija, vrtoglavica in napadi. Za razliko od SARS-CoV, pri okužbi s SARS-CoV-2 ti simptomi nastopijo že v zgodnjih fazah bolezni. Nevrološki simptomi, ki nastanejo po okužbi s SARS-CoV-2, imajo nato negativen vpliv na žilno homeostazo, prilagajanje imunskega odziva in kognicijo 12. Vstop virusa v možgansko deblo je bil do sedaj potrjen le v nekaj primerih, vendar nakazuje na morebitno patofiziološko pot za nastanek respiratorne odpovedi 13, saj je ravno medula, ki je del možganskega debla, odgovorna za kontrolo dihanja kot tudi za druge nezavedne življenjsko pomembne funkcije.
Dosedanje ugotovitve torej kažejo, da COVID-19 lahko predstavlja nevarnost za okužbo možganov ter da so kadilci ter posamezniki z oslabljenim imunskim sistemom dovzetnejši za okužbo in nastanek nevroloških komplikacij.
-
___
-
Guan W. et al., 2020. Comorbidity and its impact on 1,590 patients with COVID-19 in China: A Nationwide Analysis. medRxiv, doi: 10-1101/2020.02.25.20027664. ↩
-
Qi F., Qian S., Zhang S., Zhang Z., 2020. Single cell RNA sequencing of 13 human tissues identify cell types and receptors of human coronaviruses. bioRxiv, doi: 10.1101/2020.02.16.951913. ↩
-
Nordman et al., 2014. The α4 nicotinic receptor promotes CD4+ T-cell proliferation and a helper T-cell immune response. Molecular Pharmacology, 85: 50-61. ↩
-
Inoue et al., 2007. Clathrin-dependent entry of severe acute respiratory syndrome coronavirus target cells expressing ACE2 with the cytoplasmic tail deleted. Journal of Virology, doi: 10.1128/jvi.00253-07. ↩
-
Olds J.L., Kabbani N., 2020. Is nicotine exposure linked to cadriopulmonary vulnderability to COVID-19 in the general population? FEBS Journal, doi: 10.1111/febs.15303. ↩
-
Kaparianos A., Argyropoulou E., 2011. Local reninangiotensin II systems, angiotensin-converting enzyme and its homologue ACE2: their potential role in the pathogenesis of chronic obstructive pulmonary diseases, pulmonary hypertension and acute respiratory distress syndrome. Current Medicinal Chemistry, doi: 10.2174/092986711796642562. ↩
-
Hung et al., 2016. Alternative rles of STAT3 and MAPK signaling pathways in the MMPs activation and progression of lung injury induced by cigarette smoke exposure in ACE2 knockout mice. International Journal of Biological Science, doi: 10.7150/ijbs.13379. ↩
-
Labandeira-Garcia et al., 2014. Brain renin-angiotensin system and dompaniergic cell vulnerability. Frontiers in Neuroanatomy, doi: 10.3389/fnana.2014.00067. ↩
-
Dani J.A., Bertrand D., 2007. Nicotinic acetylcholine receptors and nicotinic cholinergic mechanisms of the central nervous system. Annual Reviews in Pharmacology and Toxicology, 47: 699-729. ↩
-
Mao et al., 2020. Implications of COVID-19 for patients with pre-existing digestive diseases. The Lancet Gastroenterology and Hepatology, doi: 10.1016/S2468-1253(20)30076.5. ↩
-
Kabbani N., Olds J.L., 2020. Does COVID19 infect the brain? If so, smokers might be at a higher risk. Molecular Pharmacology Fast Forward, doi: 10.1124/molpharm.120.000014. ↩
-
Li Y.-C., Bai W.-Z., Hashikawa T., 2020. The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients. Journal of Medical Virology, doi: 10.1002/jmv.25728. ↩
dr. Maša Čater, univ. dipl. bioteh.
Inštitut za predklinične vede, Laboratorij za genomiko živali
Veterinarska fakulteta, Univerza v Ljubljani