Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Vloga celičnih membran pri okužbi, pomnoževanju in sproščanju koronavirusa hudega akutnega dihalnega sindroma 2 (SARS-CoV-2)
letnik 2020, številka 18
uvodnik
Maša Čater
članki
Bolezni spektra anti-MOG pri odraslih
Nik Krajnc
Samomor pod lupo nevroznanosti
Alina Holnthaner
intervjuji
Miha Pribošič
aktualno
Preplet možganov in imunskega sistema v času stresa
Dolores Trol
kolofon
letnik 2020, številka 18
Zaradi bolezni COVID-19, ki jo povzroča koronavirus hudega akutnega dihalnega sindroma 2 (angl. Severe Acute Respiratory Syndrome Coronavirus 2, SARS-CoV-2), je Svetovna zdravstvena organizacija (WHO) 11. marca 2020 razglasila pandemijo. Velikost virusne kroglice je zgolj nekaj več kot 100 nm, a svetovnemu prebivalstvu predstavljata grožnjo tako njegovo hitro razširjanje kot raznolike posledice za zdravje, ki jih ta koronavirus povzroča. Čeprav je SARS-CoV-2 precej nov virus, zahvaljujoč hitremu napredku v znanosti o njem vemo že marsikaj. Kakšna je vloga celičnih membran pri vstopu, pomnoževanju in odstranjevanju virusa, je vidik, ki obeta razvoj novih farmakoloških pristopov.
S krioelektronsko mikroskopijo so določili tridimenzionalno strukturo t. i. spike proteina1, določili so tudi že zaporedje njegovega genoma v obliki pozitivno smiselne enovijačne molekule RNA 2. Iz zaporedja nukleotidov in sprememb glede na druge podobne viruse sklepajo, da je šlo za naravno evolucijo od izvornega virusa v netopirjih3, ki je prek ne dovolj jasnega posrednika (govorijo o luskavcu) preskočil na človeka. To sklepajo predvsem iz številnih mutacij v spike proteinu, ki so po njihovem mnenju rezultat naravne selekcije3. Ni pa povsem izključeno, da se je virus po nesreči razširil v okolico iz bližnjega virološkega laboratorija, kjer so viruse netopirjev preučevali v raziskovalni skupini Zheng-Li 4, 5. Ne glede na potencialno nevarnost in omejitve pri študiju nevarnih umetnih virusov, prirejenih iz naravnih virusov netopirjev, so ti virologi iz laboratorija v Vuhanu skupaj z Američani iz univerze Carolina raziskovali himerni virus SARS-CoV z vgrajenim spike proteinom iz drugega virusa, ki je močneje vezal človeški receptor ACE2 (angl. Angiotensin-Converting Enzyme 2) v celični kulturi pljučnega epitelija6. Pomenljivo je, da spike protein aktualnega virusa SARS-CoV-2 tudi bolje veže človeški receptor ACE2 od tistega v virusu SARS-CoV, kar pripomore k njegovi večji infektivnosti. V študiji iz leta 2015 6 so znanstveniki na to možnost sicer opozarjali in tudi nameravali pripraviti cepivo, ki bi tak virus nevtraliziralo. Ali gre za isto osnovno sekvenco obeh omenjenih virusov, bo vsekakor potrebno preveriti.
Celični receptor ACE2 je torej glavno vezavno mesto SARS-CoV-2. Precej je razširjen v pljučih in jetrih, pa tudi v možganskem tkivu, kamor SARS-CoV-2 dostopa ali preko povečane prepustnosti krvno-možganske pregrade ali preko zaušesnega mehkega tkiva in ušesnega živca 7, 8. Kako se vdor virusa v možganska tkiva odraža na spremenjena nevrološka stanja, je pregledno opisano drugje8. Nevrološki znaki se kažejo kot glavobol, nezaznavanje vonja, krvavitve kapilar ali v težjih primerih tudi v izgubi zavesti.
ZZa razliko od drugih koronavirusov je SARS-CoV-2 pridobil novo cepitveno mesto za gostiteljsko serinsko proteazo furin, katere cepitev na S2 delu spike proteina pomaga virusu, da se aktivira na membrani gostitelja 9. Za interakcijo med furinu podobnimi proteazami in cepitvenimi mesti (substrati) so že za druge korona viruse pokazali, da so pomembne determinante neurotropizma10.
Virusni proteazi, ki nastaneta s cepitvami dolgega virusnega proteina, sta dveh tipov: prva je papainu podobna proteaza (angl. Papain-like Protease, PLpro) in druga je t. i. glavna proteaza (3CLpro). Ob poznavanju zaporedja virusne RNA so se strukturni biologi s homolognim modeliranjem lotili predvidevanja 3D-strukture papainu podobne proteaze virusa SARS-CoV11, kmalu po izbruhu sedanje pandemije pa so določili kristalno strukturo glavne proteaze 3CLpro virusa SARS-CoV-2, na katero je bil vezan inhibitor12. Glavna virusna proteaza 3CLpro je po strukturi podobna kimotripsinu, vendar spominja na cisteinske proteaze. Po nomenklaturi MEROPS glavna SARS virusna proteaza spada v klan C30 endopeptidaz. Struktura je v obliki dimera z dvema aktivnima mestoma z dodatno α-helično domeno.
Poznavanje proteinov koronavirusa SARS-CoV-2, predvsem njegovih proteaz, je ključno za razvoj novih terapevtikov. Potencialna zdravila proti virusu SARS-CoV-2 so namreč za razliko od cepiv in imunoterapije majhne molekule v vlogi ligandov gostiteljskih receptorjev ali inhibitorjev gostiteljskih proteaz. Proteaze, med njimi furin, cepijo virusni površinski spike protein in s tem virus aktivirajo za zlitje z membrano in interakcijo z receptorji ACE2. Ker so ti receptorji in proteaze gostitelju lastni proteini, imajo svoje pomembne funkcije v fiziologiji našega organizma, zato njihova inhibicija ni vselej zaželena. V tem pogledu so bolj obetavne in specifične tarče virusu lastni proteini, kot so proteaze in polimeraze.
Z metodami kemometrije in bioinformatike številni laboratoriji iščejo manjše molekule, ki ciljajo na virusne proteaze ali polimeraze. Z znanjem 3D-struktur virusnih proteaz, predvsem glavne proteaze 3CLpro12 se je začel pravi lov na majhne spojine, morda že znana zdravila ali pa spojine rastlinskega izvora, ki bi virusno proteazo specifično inhibirali. Med kemijskimi spojinami navajajo ketoamide12, 13. Pred kratkim je izšel članek, ki navaja nekaj spojin, dobljenih z metodami umetne inteligence, ki so kandidati za inhibitorje glavne proteaze 14.
Naše študije niso neposredno povezane z virusi, ukvarjamo se s proteinsko agregacijo in vitro in v celicah, kar je namenjeno boljšemu poznavanju molekularnih osnov nevrodegeneracije. Obstajajo namreč podobnosti med principi toksičnih proteinskih agregatov in sestavljanjem in odstranjevanjem virusnih delcev, kjer so v obeh primerih vključene celične membrane.
V naslednjih dveh razdelkih najprej opišemo, katere membranske proteine ima virus in kakšne so njihove funkcije. Zatem pa primerjamo napad virusa na celico s porušenjem proteostaze, ki je posledica proteinske agregacije, in vlogo membran pri teh procesih.
Membranski proteini virusa
Virus vstopa v celico preko endocitoze. Vsi koronavirusi sestojijo iz nukleokapsidnega proteina N, površinskega proteina E in spike proteina S, poleg strukturiranih membranskih proteinov M. Gre za virus z ovojnico in površinski proteini S, M in E se srečajo s celično membrano gostitelja, kjer se začne infekcija. Zatem se vgradijo v endoplazmatski retikulum (ER) gostiteljske celice tekom procesa translacije, nazadnje pa grejo v sekretorno pot, ko se zreli delci virusa sprostijo iz okužene celice. Tudi nestrukturirani proteini virusa interagirajo z membranami. Pomnoževanje virusa poteka v specializiranih organelih, ki jih inducirajo virusni proteini, ki uporabijo celične membrane in se tako izognejo izvornemu imunskemu odzivu 15,16.
Ločimo strukturirane in nestrukturirane proteine virusa, skupaj jih je okoli 26. Strukturirani proteini sodelujejo pri ključnih stopnjah infekcije, kot je fuzija virusne in gostiteljske membrane, ki poteče s strukturiranim membranskim spike proteinom S. Protein S sestoji iz dveh domen; S1 in S2, kjer se N-terminal S1 veže na receptor ECE-2 na membrani gostitelja, medtem ko se S2 s C-terminalnim delom zlije z membrano gostitelja. Protein S cepijo gostiteljske proteaze, med njimi so katepsini in transmembranska serinska proteaza (TMPRSS2). Nekatere študije omenjajo tudi furin, saj ima SARS-CoV-2 takšno vezavno mesto na S2 delu9. Ko se S1 veže na receptor in postane del lipidnega vezikla, S2 deluje kot most, ki približa membrano gostitelja in virusa, da se zlijeta v eno. Pri endocitozi ima pomembno vlogo s klatrinom prekrit endocitozni vezikel, ki sprosti fuzijski peptid, ta pa reagira z lipidno membrano vezikla. Nastane 6-helični kanalček v membrano. Sklepajo, da se fuzijski peptid nahaja na N- terminalu S2, kjer se nahaja dobro ohranjen motiv IEDLLF.
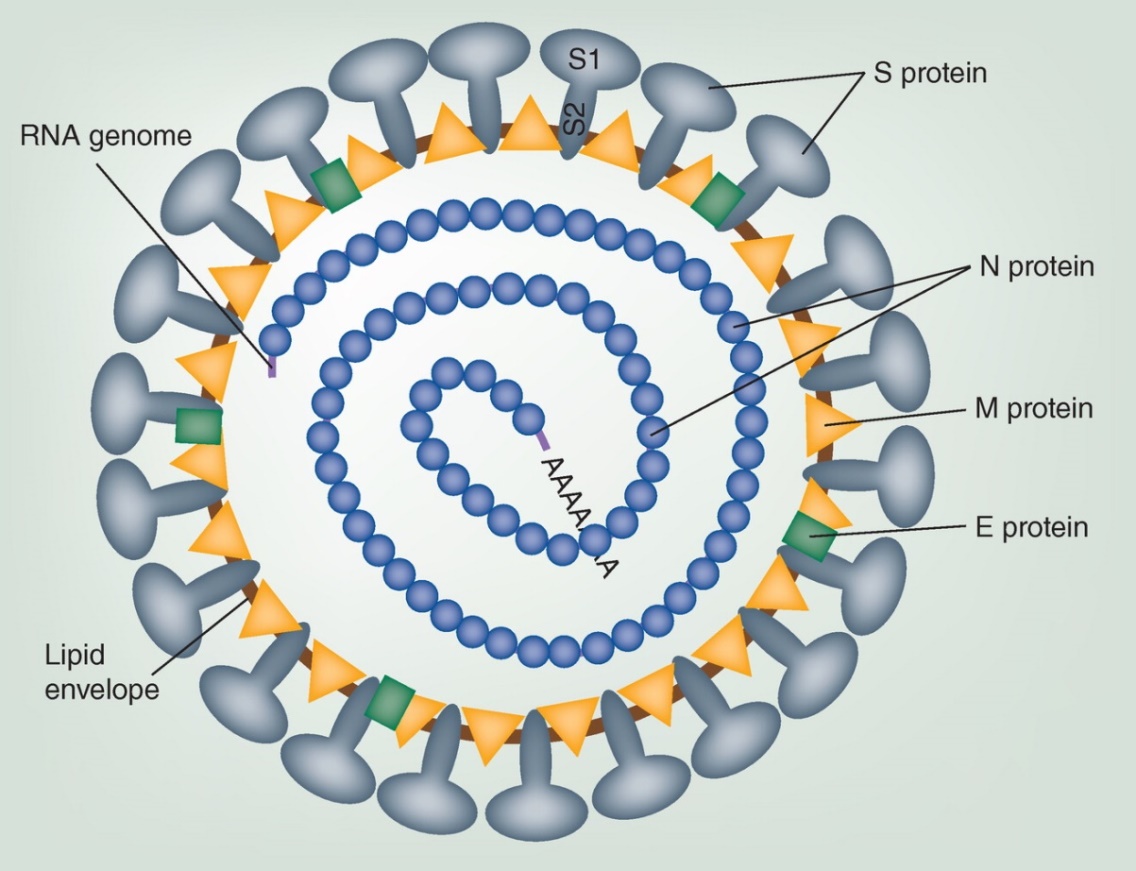
Slika 1: Shematski opis virusnega delca. Na lipidni ovojnici (lipid envelope) so prikazani strukturirani proteini na površini : t. i. spike protein S, nukleokapsidni protein N, transmembranski glikoprotein M in protein lipidne ovojnice (envelope) – protein E. Nakazan je tudi genom iz enoverižne RNA 15.
Virusni membranski protein E deluje kot membranski kanalček, t. i. viroporin. Ta funkcija proteina E je pomembna za transport virusnih delcev po sekretorni poti in za membransko prepustnost, kar je spet pomembno za nastajanje novih virusnih delcev. Prepustnost membrane mobilizira kalcijeve ione in ti reagirajo z gostiteljskimi proteini v vrzelih med epitelijskimi celicami. O vlogi proteina E so s študijem njegovih mutacij dokazali, da je pomemben za sprostitev novih virusov kot tudi za signaliziranje vnetnih citokinov in za ER stresni odziv 17.
Virusni protein M je transmembranski protein tipa III in je najpogostejši med glikoproteini v virusnem delcu. To je protein z 230 aminokislinskimi ostanki in sestoji iz 3 delov: krajše N-terminalne domene, ki moli izven virusne membrane, treh transmembranskih domene in C-terminalne domene, ki sega znotraj delca. Protein M interagira s proteinoma S in E.
Daljši nestrukturirani proteini virusa so pomembni za tvorjenje membranskih mešičkov, kjer se virus zaščiteno pomnožuje. Že samo izražanje teh proteinov omogoča virusu, da tvori mešičke, obdane z dvojno lipidno membrano. Nsp3, 4 in 6 imajo pomembne funkcije pri preureditvi celičnih membran v kompleks za pomnoževanje in translacijo virusne RNA.
Tarčenje virusnih in celičnih membran bi lahko bilo uporabno za preprečevanje vstopa in zlitja virusa z gostiteljsko membrano in kasneje v celici za njegovo podvajanje. Možni kandidati so peptidi, ki delujejo kot antagonisti vezave na membrano ali na receptorje.
Proteostaza gostiteljske celice kot morebitna farmakološka tarča
Avtofagosomi imajo dvojno membrano in niso direktno povezani z dvomembranskimi lipidnimi mešički (angl. Double Membrane Vesicles, DMV), torej z virusnimi mešički, ki nastajajo z invaginacijo dvojne membrane ER. Avtofagija je protektivna in požre tudi te mešičke. Povezava pa je še bolj kompleksna: agregacija proteinov vodi do nastanka objedrnih struktur, obdanih z dvojno membrano, imenovanih agresomi. Ti naj bi bili mesta pomnoževanje virusa 18,19, a tudi agresome nazadnje razgradi avtofagija. Poleg dvojnih enkapsulacij iz Golgijevega aparata, ER in avtofagosomov, si večji jedrno/citoplazemski DNA-virusi (NCLDV) delijo pota skupaj s proteinskimi agregati (zbranih v agresomih) ob mikrotubulih (MTOC), blizu jedra in tvorijo t. i. virusne tovarne, kjer poteka pomnoževanje virusnih delcev18. Za večje viruse NCLDV so to mesta za pomnoževanje, za manjše pa podobno kot za proteinske agregate pride do razgradnje z avtofagijo. Stradanje in nekateri modulatorji na osnovi rapamicina avtofagijo povečajo, s tem očistijo celico proteinskih agregatov, a to lahko pripelje do prekinjene avtofagije, nabiranja avtofagosomov in celične smrti oz. nevrodegeneracije. Sicer v kontekstu Alzheimerjeve bolezni20 navajajo – a principi so podobni –, da karbamazepin, latrepiridin, litij in trehaloza lahko modificirajo avtofagijo. Kdaj in kako dokončati, pospešiti avtofagijo v nevrodegenerativnih in virusnih boleznih ni vselej lahka odločitev in ostaja odprto vprašanje.
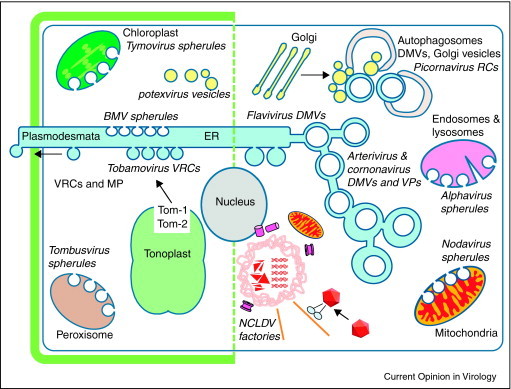
Slika 2: Mesta za pomnoževanje rastlinskih (na levi) in živalskih virusov (na desni). Živalski virusi alfavirusi in nodavirusi tvorijo sferule ob endosomalno-lizosomalnem sistemu in ob mitohondrijih. Koronavirusi, arterivirusi in flavivirusi tvorijo DMV iz ER, medtem ko koronavirusi in arterivirusi tvorijo paketke iz veziklov18.
-
___
-
Wrapp, D., and Wang, N. (2020) Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation, 367, 1260-1263. ↩
-
Zhang, Y. Z., and Holmes, E. C. (2020) A Genomic Perspective on the Origin and Emergence of SARS-CoV-2, Cell 181, 223-227. ↩
-
Andersen, K. G., and Rambaut, A. (2020) The proximal origin of SARS-CoV-2, 26, 450-452. ↩
-
Ge, X. Y., Li, J. L., Yang, X. L., Chmura, A. A., Zhu, G., Epstein, J. H., Mazet, J. K., Hu, B., Zhang, W., Peng, C., Zhang, Y. J., Luo, C. M., Tan, B., Wang, N., Zhu, Y., Crameri, G., Zhang, S. Y., Wang, L. F., Daszak, P., and Shi, Z. L. (2013) Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor, Nature 503, 535-538. ↩
-
Zhou, P., Yang, X. L., Wang, X. G., Hu, B., Zhang, L., Zhang, W., Si, H. R., Zhu, Y., Li, B., Huang, C. L., Chen, H. D., Chen, J., Luo, Y., Guo, H., Jiang, R. D., Liu, M. Q., Chen, Y., Shen, X. R., Wang, X., Zheng, X. S., Zhao, K., Chen, Q. J., Deng, F., Liu, L. L., Yan, B., Zhan, F. X., Wang, Y. Y., Xiao, G. F., and Shi, Z. L. (2020) A pneumonia outbreak associated with a new coronavirus of probable bat origin, Nature 579, 270-273. ↩
-
Menachery, V. D., Yount, B. L., Jr., Debbink, K., Agnihothram, S., Gralinski, L. E., Plante, J. A., Graham, R. L., Scobey, T., Ge, X. Y., Donaldson, E. F., Randell, S. H., Lanzavecchia, A., Marasco, W. A., Shi, Z. L., and Baric, R. S. (2015) A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence, Nature medicine 21, 1508-1513. ↩
-
Baig, A. M., Khaleeq, A., Ali, U., and Syeda, H. (2020) Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host-Virus Interaction, and Proposed Neurotropic Mechanisms, ACS chemical neuroscience 11, 995-998. ↩
-
Wu, Y., Xu, X., Chen, Z., Duan, J., Hashimoto, K., Yang, L., Liu, C., and Yang, C. (2020) Nervous system involvement after infection with COVID-19 and other coronaviruses, Brain, behavior, and immunity. ↩
-
Coutard, B., Valle, C., de Lamballerie, X., Canard, B., Seidah, N. G., and Decroly, E. (2020) The spike glycoprotein of the new coronavirus 2019-nCoV contains a furin-like cleavage site absent in CoV of the same clade, Antiviral research 176, 104742. ↩
-
Vavougios, G. D. (2020) Host proteases as determinants of coronaviral neurotropism and virulence, Brain, behavior, and immunity. ↩
-
Báez-Santos, Y. M., St John, S. E., and Mesecar, A. D. (2015) The SARS-coronavirus papain-like protease: structure, function and inhibition by designed antiviral compounds, Antiviral research 115, 21-38. ↩
-
Zhang, L., and Lin, D. (2020) Crystal structure of SARS-CoV-2 main protease provides a basis for design of improved α-ketoamide inhibitors, 368, 409-412. ↩
-
Zhang, L., Lin, D., Kusov, Y., Nian, Y., Ma, Q., Wang, J., von Brunn, A., Leyssen, P., Lanko, K., Neyts, J., de Wilde, A., Snijder, E. J., and Liu, H. (2020) α-Ketoamides as Broad-Spectrum Inhibitors of Coronavirus and Enterovirus Replication: Structure-Based Design, Synthesis, and Activity Assessment. ↩
-
Zhavoronkov, A., Aladinskiy, V., Zhebrak, A., Zagribelnyy, B., Terentiev, V., Bezrukov, D., Polykovskiy, D., Shayakhmetov, R., Filimonov, A., Orekhov, P., Yan, Y., Popova, O., Vanhaelen, Q., Aliper, A., and Ivanenkov, Y. (2020) Potential 2019-nCoV 3C-like protease inhibitors designed using generative deep learning approaches. ↩
-
EA, J. A., and Jones, I. M. (2019) Membrane binding proteins of coronaviruses, Future virology 14, 275-286. ↩
-
Ulasli, M., Verheije, M. H., de Haan, C. A., and Reggiori, F. (2010) Qualitative and quantitative ultrastructural analysis of the membrane rearrangements induced by coronavirus, Cellular microbiology 12, 844-861. ↩
-
Li, S., Yuan, L., Dai, G., Chen, R. A., Liu, D. X., and Fung, T. S. (2019) Regulation of the ER Stress Response by the Ion Channel Activity of the Infectious Bronchitis Coronavirus Envelope Protein Modulates Virion Release, Apoptosis, Viral Fitness, and Pathogenesis, Front Microbiol 10, 3022. ↩
-
Netherton, C. L., and Wileman, T. (2011) Virus factories, double membrane vesicles and viroplasm generated in animal cells, Current opinion in virology 1, 381-387. ↩
-
Wileman, T. (2006) Aggresomes and autophagy generate sites for virus replication, Science 312, 875-878. ↩
-
Uddin, M. S., Stachowiak, A., Mamun, A. A., Tzvetkov, N. T., Takeda, S., Atanasov, A. G., Bergantin, L. B., Abdel-Daim, M. M., and Stankiewicz, A. M. (2018) Autophagy and Alzheimer’s Disease: From Molecular Mechanisms to Therapeutic Implications, Frontiers in Aging Neuroscience 10. ↩
Dr. Eva Žerovnik, prof. biokem.
Odsek za Biokemijo in Molekularno in Strukturno Biokemijo
Inštitut »Jožef Stefan«
Jamova 39,
1000 Ljubljana, Slovenija
Prejeto: 14.4.2020
Objavljeno: 1.6.2020