Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Zdravljenje z matičnimi celicami kot upanje za paciente s poškodbo hrbtenjače
kako daleč smo od učinkovitega zdravljenja z matičnimi celicami?
članki
eSinapsa, 2011-1
Zvezdan Pirtošek
Eksoskeleti – inteligentne bionske naprave
Marko Munih
O aktualnih dilemah draženja globokih možganskih struktur pri obsesivno - kompulzivni motnji
Nadja Jarc
Sledite svojo srečo ... z iPhone
Urban Kordeš
eSinapsa, 2011-2
Renata Salecl
Gašper Tkačik
Astrociti – spregledane zvezde nevrobiologije
Marko Kreft, Robert Zorec
Sašo Dolenc
Meditacija - malo truda, veliko koristi
Luka Dimic
eSinapsa, 2011-3
Mara Bresjanac
Martina Starc
Rok Berlot
Varnost uporabe generičnih protiepileptičnih zdravil
Mojca Kržan, Matevž Kržan
Možgani, računalniki - nekaj vmes
Miha Pelko
eSinapsa, 2012-4
Ali so moški in ženski možgani različni?
Gregor Majdič
O kognitivnih motnjah pri bolnikih s Parkinsonovo boleznijo
Dejan Georgiev
Akutno možgansko kap lahko uspešno zdravimo
Nina Vujasinovič, Bojana Žvan
Vloga nevropsihološke diagnostike pri odkrivanju zgodnjih znakov alzheimerjeve bolezni
Simon Brezovar
eSinapsa, 2013-5
Subarahnoidna krvavitev zaradi tromboze venskih sinusov
Mateja Repar, Anita Resman Gašperčič
Srečanje dveh velikanov: možganov in imunskega sistema
Matej Markota
Novo odkritje na področju sporadičnih prionskih bolezni
Jana Jerše, Nadja Jarc
Učinek placeba brez lažnih zdravil in zavajanja
Mara Bresjanac
eSinapsa, 2013-6
Odstranjevanje možganskih tumorjev pri budnem bolniku
Andrej Vranič, Jasmina Markovič, Blaž Koritnik
Zmedena bolnica, ki nič ne vidi ali PRES
Manja Hribar, Vid Zgonc
Manja Hribar
Sistemska skleroza in ishemična možganska kap - vzročna povezanost ali le koincidenca?
Mateja Repar, Janja Pretnar Oblak
Netravmatska lokalizirana konveksitetna subarahnoidna krvavitev
Mateja Repar, Fajko F. Bajrović
Klemen Grabljevec
Z omejevanjem spodbujajoča terapija pri bolnikih po nezgodni možganski poškodbi
Dejana Zajc, Klemen Grabljevec
eSinapsa, 2014-7
Možgani v mreži navezanosti, ki nas zaznamuje
Barbara Horvat
Vpliv senzoričnega dotoka na uglasitev možganskih povezav
Peter Gradišnik
Človeški konektom ali kakšne so zveze v naših možganih
Blaž Koritnik
Niko Lah
Torkove delavnice za osnovnošolce
Mateja Drolec Novak, Vid V. Vodušek
Da ne pozabim! Tehnike za pomladitev spomina
Klara Tostovršnik, Hana Hawlina
Površina socialne nevroznanosti
Manuel Kuran
Clarity - bistri možgani Karla Deisserotha
Gregor Belušič
Barbara Gnidovec Stražišar
Bojana Žvan
Nevroplastičnost po možganski kapi
Marjan Zaletel
Klinično psihološka obravnava pacientov po možganski kapi in podpora pri vračanju na delovno mesto
Barbara Starovasnik Žagavec
Možgani: organ, s katerim ljubimo
Andraž Matkovič
Marija Šoštarič Podlesnik
Gibalno-kognitivna vadba: praktična delavnica
Mitja Gerževič, Marina Dobnik
Anton Grad
Nevrologija, imunologija, psihiatrija …
Bojan Rojc
Andraž Stožer, Janez Bregant
Dominika Novak Pihler
Možganska kap – »kako ostati v omrežju?«
Nina Ozimic
Klara Tostovršnik
eSinapsa, 2014-8
Znotrajžilno zdravljenje možganskih anevrizem
Tamara Gorjanc, Dimitrij Lovrič
Obravnava hladnih možganskih anevrizem
Bojana Žvan, Janja Pretnar Oblak
Ali deklice z Rettovim sindromom govorijo z očmi?
Anka Slana, Urška Slana
Progresivna multifokalna encefalopatija
Urša Zabret, Katarina Šurlan Popovič
Ne ubijaj – poskusi na živalih
Martina Perše
Poizkusi na živalih - za in proti
Simon Horvat
eSinapsa, 2015-9
Kako deluje navigacijski sistem v naših možganih
Simon Brezovar
Vsakodnevno delo slepe osebe / s slepo osebo
Denis Kamnar
Uroš Marušič
Manca Tekavčič Pompe
Toni Pustovrh
Marko Hawlina
Od svetlobe do podobe ali kako vidijo svet naši možgani
Simon Brezovar
Janja Hrastovšek
Zala Kurinčič
Pogledi na mejno osebnostno motnjo
Jerica Radež, Peter Kapš
Uvid kot socialno psihološki fenomen
Vid Vodušek
Uvod v vidno-prostorske funkcije s praktičnimi primeri
Ana Bujišić, Sanja Roškar
eSinapsa, 2015-10
Difuzijsko magnetnoresonančno slikanje
Rok Berlot
Katja Pavšič
Radiološko izolirani sindrom - ali ga moramo poznati?
Matej Vouk, Katarina Šurlan Popovič
Kako izgledajo možgani, ki govorijo več jezikov?
Gašper Zupan
Nov pristop v rehabilitaciji - terapija s pomočjo psa
Mateja Drljepan
Pogled v maternico z magnetnoresonančno preiskavo
Taja Jordan, Tina Vipotnik Vesnaver
Saša Zorjan
Saša Zorjan
Nevroestetika: ko nevroznanost obišče galerijo
Anja Voljavec, Hana Hawlina, Nika Vrabič
Ali so psihogeni neepileptični napadi res psihogeni?
Saška Vipotnik, Gal Granda
Kako nam lahko glasna glasba »vzame« sluh in povzroči tinitus
Nejc Steiner, Saba Battelino
eSinapsa, 2016-11
Mara Bresjanac
Kako ultrazvok odpira pot v možgane
Kaja Kolmančič
Kako je epigenetika spremenila nevroznanost
Metka Ravnik Glavač
Ondinino prekletstvo ali sindrom prirojene centralne hipoventilacije
Katja Pavšič, Barbara Gnidovec Stražišar, Janja Pretnar Oblak, Fajko F. Bajrović
Zika virus in magnetnoresonančna diagnostika nepravilnosti osrednjega živčevja pri plodu
Rok Banko, Tina Vipotnik Vesnaver
Motnje ravnotežja otrok in odraslih
Nejc Steiner, Saba Battelino
eSinapsa, 2016-12
Vloga magnetnoresonančne spektroskopije pri obravnavi možganskih tumorjev
Gašper Zupan, Katarina Šurlan Popovič
Tiskanje tridimenzionalnih modelov v medicini
Andrej Vovk
Aleš Oblak
Kevin Klarič
Sinestezija: umetnica, ki ne želi odrasti
Tisa Frelih
Računska psihiatrija: od nevroznanosti do klinike
Nastja Tomat
Kognitivni nadzor: od vsakdanjega življenja do bolezni
Vida Ana Politakis
eSinapsa, 2017-13
Internet: nadgradnja ali nadomestek uma?
Matej Perovnik
Vloga črevesnega mikrobioma pri odzivu na stres
Vesna van Midden
Stres pušča posledice tako na človeškem kot živalskem organizmu
Jasmina Kerčmar
Prikaz normalne anatomije in bolezenskih stanj obraznega živca z magnetno resonanco
Rok Banko, Matej Vrabec
Psihedelična izkušnja in njen zdravilni potencial
Anja Cehnar, Jona Basle
Vpliv hiperglikemije na delovanje možganov
Jasna Šuput Omladič, Simona Klemenčič
Nevrofibromatoza: napredujoče obolenje centralnega in perifernega živčevja
Nejc Steiner, Saba Battelino
Fenomen žrtvenega jagnja v dobi interneta
Dolores Trol
Tesnoba staršev in strategije spoprijemanja, ko pri otroku na novo odkrijejo epilepsijo
Daša Kocjančič, Petra Lešnik Musek, Vesna Krkoč, David Gosar
eSinapsa, 2017-14
Zakaj ne zapeljem s ceste, ko kihnem?
Anka Slana Ozimič, Grega Repovš
Možgani pod stresom: od celic do duševnih motenj
Nastja Tomat
Nobelova nagrada za odkritje molekularnih mehanizmov nadzora cirkadianih ritmov
Leja Dolenc Grošelj
Na sledi prvi vzročni terapiji Huntingtonove bolezni
Danaja Metul
Razlike med spoloma pri Parkinsonovi bolezni
Kaja Kolmančič
eSinapsa, 2018-15
Susceptibilno poudarjeno magnetnoresonančno slikanje pri bolniku z ALS
Alja Vičič, Jernej Avsenik, Rok Berlot
Sara Fabjan
Reverzibilni cerebralni vazokonstrikcijski sindrom – pot do diagnoze
Maja Cimperšek, Katarina Šurlan Popovič
Liam Korošec Hudnik
Kognitivno funkcioniranje pri izgorelosti
Marina Horvat
eSinapsa, 2019-16
Maša Čater
Saša Koprivec
Infekcije osrednjega živčnega sistema s flavivirusi
Maja Potokar
Raziskava: Kako depresija vpliva na kognitivne sposobnosti?
Vida Ana Politakis
Razvoj depresije pri otrocih z vidika navezovalnega vedenja
Neža Grgurevič
Sonja Prpar Mihevc
Umetno inteligentna nevroznanost: srečanje nevronskih mrež in možganske fiziologije
Kristijan Armeni
Čebelji strup pri preventivi nevrodegenerativnih bolezni in priložnost za klinično prakso
Matjaž Deželak
eSinapsa, 2019-17
IgG4+ – skupni imenovalec diagnoz iz preteklosti
Cene Jerele, Katarina Šurlan Popovič
Nov molekulski mehanizem delovanja ketamina v astrocitih
Matjaž Stenovec
Praktični pristop k obravnavi utrujenosti in motenj spanja pri bolnikih z multiplo sklerozo
Nik Krajnc, Leja Dolenc Grošelj
Jure Pešak
eSinapsa, 2020-18
Bolezni spektra anti-MOG pri odraslih
Nik Krajnc
Samomor pod lupo nevroznanosti
Alina Holnthaner
eSinapsa, 2020-19
Ob mednarodnem dnevu znakovnih jezikov
Anka Slana Ozimič
Teorija obetov: kako sprejemamo tvegane odločitve
Nastja Tomat
Sara Fabjan
Matjaž Deželak
Nina Stanojević, Uroš Kovačič
Od človeških nevronov do možganskih organoidov – nova obzorja v nevroznanosti
Vesna M. van Midden
Splošna umetna inteligenca ali statistične jezikovne papige?
Kristijan Armeni
Zunajcelični vezikli kot prenašalci zdravilnih učinkovin preko krvno-možganske prepreke
Saša Koprivec
Matjaž Deželak
eSinapsa, 2021-20
Migrena: starodavna bolezen, sodobni pristopi k zdravljenju
Eva Koban, Lina Savšek
Zgodnji razvoj socialnega vedenja
Vesna Jug
Nastja Tomat
Mikrosplet: povezovanje preko mikrobioma
Tina Tinkara Peternelj
Stimulacija možganov kot način zdravljenja depresije
Saša Kocijančič Azzaoui
eSinapsa, 2021-21
eSinapsa, 2022-22
Sodobni vidiki motenj hranjenja
Karin Sernec
Ples in gibalni dialog z malčki
Neva Kralj
Atul Gawande
Jezikovna funkcija pri Alzheimerjevi bolezni
Gašper Tonin
Dostava terapevtikov preko krvno-možganske pregrade
Matjaž Deželak
eSinapsa, 2022-23
Akutni ishemični infarkt hrbtenjače pri zdravih otrocih – kaj lahko pove radiolog?
Katarina Šurlan Popovič, Barbara Šijaković
eSinapsa, 2023-24
Možganska omrežja pri nevrodegenerativnih boleznih
Tomaž Rus, Matej Perovnik
Morske živali kot navdih za nevroznanstvenike: morski konjiček, morski zajček in klobučnjak
Tina Bregant
Metoda Feldenkrais: gibanje in nevroplastičnost
Mateja Pate
Etično naravnana animalna nevroznanost
Maša Čater
Helena Motaln, Boris Rogelj
eSinapsa, 2023-25
Urban Košak, Damijan Knez, Anže Meden, Simon Žakelj, Jurij Trontelj, Jure Stojan, Maja Zakošek Pipan, Kinga Sałat idr.
eSinapsa, 2024-26
Naravno okolje kot vir zdravja in blagostanja
Karin Križman, Grega Repovš, Gaja Zager Kocjan, Gregor Geršak
Katja Peganc Nunčič, Damjan Osredkar
Tanja Goltnik
Ali je zgodnje vstajanje dedno?
Cene Skubic, Laura Plavc, Damjana Rozman, Leja Dolenc Grošelj
eSinapsa, 2024-27
Širša terapevtska uporaba ketamina: potenciali in izzivi
Kristian Elersič
Moč vpliva socialne opore na bolečino
Jana Verdnik
Benjamin Bušelič
Urška Černe, Anemari Horvat, Robert Zorec, Nina Vardjan
eSinapsa, 2025-28
Maša Čater, Nastja Blagovič, Urška Jerič, Agata Kokalj Malovrh, Nuša Balen, Tanja Kunej
Vpliv izobrazbe na skrb za zdravje možganov
Hana Kos, Matej Perovnik
Selena Horvat, Anja Pišlar
Konec meseca februarja 2019 je posebna komisija japonskega ministrstva za zdravje, delo in dobrobit ljudi odobrila klinično študijo na Univerzi Keio v Tokiu, kjer bodo kot prva raziskovalna skupina na svetu s pomočjo induciranih pluripotentnih matičnih celic zdravili poškodbo hrbtenjače pri ljudeh. Uporaba induciranih pluripotentnih matičnih celic je bila do sedaj pri ljudeh dovoljena samo za klinične raziskave na področju obolenj oči, srca, kranialnih živcev in napak v tvorbi trombocitov. Raziskovalno zdravljenje bodo prejeli štirje pacienti, vsi starejši od 18 let. Vključeni bodo pacienti, ki so utrpeli direktne poškodbe hrbtenjače in pri katerih se je to izrazilo kot izguba čutenja v udih in motenj pri gibanju. Poškodba ne bo smela biti starejša od štirih tednov. Raziskovalci bodo v klinični študiji najprej poskušali inducirane pluripotentne matične celice v laboratoriju pretvoriti v predniške živčne celice in živčne matične celice. Dva milijona na novo tvorjenih živčnih matičnih in predniških živčnih celic bodo nato presadili na mesto poškodbe. V kolikor bo pri pacientih, vključenih v študijo, vidna kakršnakoli povrnitev občutka v udih v enem letu po zdravljenju, bo to dalo nove dokaze in upanje za uporabo matičnih celic tudi na tem področju. Poglaviten cilj študije v začetnem letu je dokazati varnost uporabe induciranih pluripotentnih matičnih celic za pripravo takšne terapije pri ljudeh1,2.
Poškodbe hrbtenjače
Poškodba hrbtenjače, kot rezultat prevelikega pritiska, udarnine, ali natrganja živčnega tkiva, v večini primerov hudo prizadene motorične, senzorične in avtonomne funkcije živčevja na mestu poškodbe ali nižje od nje. Pogosto vodi do delne ali celo popolne paralize udov. Pacienti izražajo neobčutljivost na bolečino, prav tako je moč opaziti odsotnost normalnega delovanja določenih organov, kot je na primer krčenje sečnega mehurja. Kljub izražanju hudih kliničnih znakov velikokrat pri poškodbi hrbtenjače ne pride do popolnega pretrganja živčnih povezav, kar pomeni, da na mestu poškodbe še ostanejo določene »zdrave« živčne celice in povezave med njimi 3,4.
Pomanjkanje rastnih beljakovin, izražanje zaviralnih dejavnikov in tvorba brazgotinskega tkiva ter cist na mestu poškodbe zelo omejujejo regenerativno sposobnost živčnega tkiva po poškodbi. Onemogočeno je normalno delovanje lastnih regenerativnih celic in njihovega podpornega okolja. S samo poškodbo se namreč sproži veriga dogodkov, kot so apoptoza celic, omejitev preskrbe s krvnim dotokom, proizvodnja prostih radikalov in znatno lokalno vnetje, le to pa lahko vpliva tudi na propadanje podpornih celic živčnega sistema. Oligodendrociti kot del tega podpornega sistema proizvajajo mielinski ovoj in omogočajo normalni prenos informacij preko živčnih celic. Tudi to prispeva k postopnem poslabšanju klinične slike po poškodbi. 3,4,5,6.
Različne strategije regenerativnih zdravljenj poškodb hrbtenjače s celičnimi terapijami
Pričetek študije v Tokiu je napovedan za poletje 2019, s tem se bo študija pridružila klinični raziskavi ameriškega podjetja Asterias, ki je v teku že tri leta. Vmesni izsledki slednje so zelo obetajoči, saj pri pacientih, vključenih v raziskavo, poročajo o povrnitvi motoričnih funkcij do določene mere. Raziskovalna skupina podjetja Asterias za razliko od raziskovalcev z Univerze Keio uporablja človeške embrionalne matične celice (EMC) kot vir celic za pripravo zdravljenja7. Razlika v izboru tipa celic za pripravo zdravljenja je lahko tehtnega pomena, saj vpliva tako na učinkovitost kot tudi na varnost zdravljenja. Pri omenjenih raziskavah se razlikujejo izhodiščne celice, ki jih uporabljajo za pretvorbo v živčne celice oz. podporne celice živčnega sistema, in tipi celic v končnem produktu, ki ga bodo presadili na mesto poškodbe 8.
Embrionalne matične celice kot vir za zdravljenje poškodbe hrbtenjače
EMC nastanejo iz pluripotentnih celic, ki v naravi obstajajo v najbolj zgodnjih stopnjah embrionalnega razvoja. Pri ljudeh jih najdemo le do petega dneva v procesu razvoja embria. Če te celice osamimo iz embria in jih gojimo v laboratoriju, v za to primernih pogojih, se teoretično lahko delijo neomejeno, ne da bi izgubile lastnosti matičnosti. Da so te celice pluripotentne, pomeni, da se lahko razvijejo v kateregakoli izmed več kot 200 tipov odraslih celic v telesu. S tem sta tudi zajeta oba parametra, ki definirata matične celice – samoobnova z neomejeno delitvijo v nove matične celice in pluripotentnost9,10. EMC v ameriški raziskovalni skupini po pridobitvi usmerijo v pretvorbo v predniške celice za oligodendrocite ter jih nato presadijo na mesto poškodbe v upanju, da bodo tvorile odrasle oligodendrocite, ki bodo posledično osvežile preživelo populacijo celic v bližini poškodbe in pomagale pri mielinizaciji živčnih celic. Prav tako so te predniške celice sposobne izločati določene molekule, ki vzpodbujajo izraščanje aksonov ter vraščanje novih živčnih celic. S tem pomagajo pri povrnitvi določenih motoričnih in senzoričnih funkcij3,7,8,11. Uporaba embrionalnih matičnih celic kot začetni vir celic za zdravljenje poškodb hrbtenjače prinaša vse prednosti, ki jih nosi njihova pluripotentna sposobnost, hkrati pa je njihovo pridobivanje zahtevno in omejeno. Prav tako je neomejena sposobnost delitve v laboratoriju. Do določene mere je ta še vedno teoretična, saj celice, ki rastejo dlje časa v kulturi, vseeno pridobijo določene genomske spremembe9,12. Uporaba predniških celic za oligodendrocite kot tip celic, ki se jih presadi na mesto poškodbe, pa ima prav tako prednosti ter slabosti. Prednost je zagotovo ta, da rešuje vprašanje demielinizacije po poškodbi hrbtenjače, in to, da so te celice sposobne vplivati na okolje, v katero jih postavimo, ter s tem pomagajo tudi pri regulaciji »neprijaznega« okolja za regeneracijo. Slabost pa je njihova omejenost za pretvorbo v druge tipe celic, saj so predniške celice usmerjene v razvoj odraslih oligodendrocitov, ne morejo pa postati recimo funkcionalne živčne celice 8,13.
Presaditev nevralnih matičnih celic in uporaba induciranih pluripotentnih celic
Predniške živčne celice in živčne matične celice, ki jih bi presajali na Japonskem, nudijo možnost tvorbe novega živčnega tkiva. Živčne matične celice imajo namreč sposobnost usmerjene pretvorbe v odrasle živčne celice in celice glia, ki delujejo kot podporne celice živčnega sistema. Inducirane pluripotentne matične celice (iPMC), ki jih bodo v japonski študiji uporabili kot vir, omogočajo razvoj pacientu lastnih matičnih celic s vsemi sposobnostmi EMC. Za njihovo pridobitev ni potrebno uničiti zarodka, saj se za pripravo iPMC uporabi odrasle celice, kot so na primer: celice kože, celice jeter, celice trebušne slinavke in druge. Le te se nato s pomočjo vnosa genetskih dejavnikov, povezanih z matičnostjo, spremeni v embrionalnim podobne matične celice, ki jih naprej spet lahko usmerjamo v poljubne tipe bolj specializiranih celic 1,9,10.
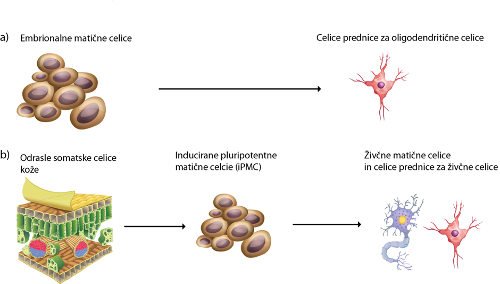 Slika 1: Potek a shematsko prikazuje pripravo terapije s predniškimi celicami za oligodendrocite. Shema b orisuje protokol, kot ga bodo uporabili na japonski univerzi Keio, in sicer pretvorbo odraslih celic v iPMC s pomočjo vnosa genetskih dejavnikov in nato pretvorbo v živčne matične celice14.
Slika 1: Potek a shematsko prikazuje pripravo terapije s predniškimi celicami za oligodendrocite. Shema b orisuje protokol, kot ga bodo uporabili na japonski univerzi Keio, in sicer pretvorbo odraslih celic v iPMC s pomočjo vnosa genetskih dejavnikov in nato pretvorbo v živčne matične celice14.Proces pridobivanja iPMC ni povsem brez nevarnosti, saj so nekateri genetskih dejavniki, ki so potrebni za pretvorbo odraslih celic v embrionalnim podobne matične celice, povezani s procesi sprožitve tumorjev. Ločevanje že pretvorjenih celic od tistih, ki so ostale v matičnem stanju, pred presaditvijo v pacienta pa je zahtevna. Kljub temu se področje hitro razvija in učinkovitost pretvorbe je z novejšimi metodami vse bolj uspešna. Prav tako je dandanes možno pri metodi uporabiti določena varovala, ki še povečajo varnost. Tako je na primer možno celice genetsko spremeniti in v njih vnesti »samomorilski gen«, ki povzroči apoptozo celice v prisotnosti določenih kemijskih spojin. Tako lahko celice, ki se niso pretvorile v živčne celice, pred nadaljnjo uporabo izločimo9,15.
V naslednjih dveh letih se lahko nadejamo dodatnih dokazov o uspešnosti in vpogledov v varnost uporabe induciranih matičnih celic.
Članek predstavlja dva pristopa, ki sta najbližje klinični uporabi pluripotentnih matičnih celic za zdravljenje poškodbe hrbtenjače in sledita pravilni poti zbiranja dovoljšnih objektivnih dokazov za učinkovitost regenerativne terapije ter njene varnosti, skozi rezultate obeh študij pa bomo videli, kateri pristop bo bolj uspešen. Nadejamo se tega, da bosta v prihodnjih dveh letih obe študiji poleg začetnih uspehov dali vpogled tudi v sam razvoj dejavnikov poškodbe in nas pripeljali korak bliže k povrnitvi funkcije, tudi po tako kompleksni poškodbi. Najverjetneje bo za dosego cilja popolne povrnitve gibalnih sposobnosti pacientov potreben bolj celosten pristop, ki bo poleg presaditve celic vključeval tudi 3D-podporo s pomočjo biokompatibilnih nosilcev ter stimulacijo z rastnimi beljakovinami. Glede na omejenost trenutnega reševanja težave in številčnosti pojava, pa je vsak dobro zastavljen korak k uspešnemu regenerativnemu zdravljenju dobrodošel.
-
___
-
Approval of Clinical Research into Regenerative Medicine Using iPS Cell-Derived Neural Stem / Progenitor Cells to Treat Subacute Spinal Cord Injuries:News:Keio University School of Medicine. Dostopno na http://www.med.keio.ac.jp/en/news/2019/3/8/37-51765/index.html. Marec 19, 2019. ↩
-
Keio to Begin World First iPS Clinical Trial for Spinal Injuries: Keio University. Dostopno na https://www.keio.ac.jp/en/news/2019/Feb/20/48-51350/. Marec 19, 2019. ↩
-
Mothe AJ, Tator CH. Review of transplantation of neural stem/progenitor cells for spinal cord injury. Int J Dev Neurosci. 2013;31:701–713. ↩
-
Ruppert KA, Olson SD, Cox CS. Chapter 13 - Spinal Cord Injury. In: Chen X-D, ed. A Roadmap to Non-Hematopoietic Stem Cell-based Therapeutics. Academic Press; 2019: 321–343. ↩
-
Curtis E, Martin JR, Gabel B, Sidhu N, Rzesiewicz TK, Mandeville R, Van Gorp S, Leerink M, Tadokoro T, Marsala S, Jamieson C, Marsala M, Ciacci JD. A First-in-Human, Phase I Study of Neural Stem Cell Transplantation for Chronic Spinal Cord Injury. Cell Stem Cell. 2018;22:941-950.e6. ↩
-
Lien BV, Tuszynski MH, Lu P. Astrocytes migrate from human neural stem cell grafts and functionally integrate into the injured rat spinal cord. Exp Neurol. 2019;314:46–57. ↩
-
About Clinical Research Study | SCiStar Study AST‐OPC1. Dostopno na http://www.scistar-study.com/about-scistar-study.html. Marec 19, 2019. ↩
-
Manley NC, Priest CA, Denham J, Wirth ED, Lebkowski JS. Human Embryonic Stem Cell-Derived Oligodendrocyte Progenitor Cells: Preclinical Efficacy and Safety in Cervical Spinal Cord Injury. Stem Cells Transl Med. 2017;6:1917–1929. ↩
-
Atala A, Lanza R, Mikos T, Nerem R. Principles of Regenerative Medicine. Academic Press; 2018: 1-1456. ↩
-
Lanza R, Atala A. Essentials of Stem Cell Biology. Academic Press; 2013: 1-709. ↩
-
Veneruso V, Rossi F, Villella A, Bena A, Forloni G, Veglianese P. Review article - Stem cell paracrine effect and delivery strategies for spinal cord injury regeneration. J Controlled Release. 2019;300:141–153. ↩
-
Kirouac DC, Zandstra PW. The Systematic Production of Cells for Cell Therapies. Cell Stem Cell. 2008;3:369–381. ↩
-
Baldassarro VA, Marchesini A, Giardino L, Calzà L. PARP activity and inhibition in fetal and adult oligodendrocyte precursor cells: Effect on cell survival and differentiation. Stem Cell Res. 2017;22:54–60. ↩
-
Cyranoski D. Japan’s approval of stem-cell treatment for spinal-cord injury concerns scientists. Nature. 2019;565:544. ↩
Luka Mohorič,
Direktor, Animacel biotehnologija d.o.o.
Objavljeno: 30.4.2019