Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Komunikacija med možgani in črevesno mikrobioto
članki
eSinapsa, 2011-1
Zvezdan Pirtošek
Eksoskeleti – inteligentne bionske naprave
Marko Munih
O aktualnih dilemah draženja globokih možganskih struktur pri obsesivno - kompulzivni motnji
Nadja Jarc
Sledite svojo srečo ... z iPhone
Urban Kordeš
eSinapsa, 2011-2
Renata Salecl
Gašper Tkačik
Astrociti – spregledane zvezde nevrobiologije
Marko Kreft, Robert Zorec
Sašo Dolenc
Meditacija - malo truda, veliko koristi
Luka Dimic
eSinapsa, 2011-3
Mara Bresjanac
Martina Starc
Rok Berlot
Varnost uporabe generičnih protiepileptičnih zdravil
Mojca Kržan, Matevž Kržan
Možgani, računalniki - nekaj vmes
Miha Pelko
eSinapsa, 2012-4
Ali so moški in ženski možgani različni?
Gregor Majdič
O kognitivnih motnjah pri bolnikih s Parkinsonovo boleznijo
Dejan Georgiev
Akutno možgansko kap lahko uspešno zdravimo
Nina Vujasinovič, Bojana Žvan
Vloga nevropsihološke diagnostike pri odkrivanju zgodnjih znakov alzheimerjeve bolezni
Simon Brezovar
eSinapsa, 2013-5
Novo odkritje na področju sporadičnih prionskih bolezni
Jana Jerše, Nadja Jarc
Učinek placeba brez lažnih zdravil in zavajanja
Mara Bresjanac
Subarahnoidna krvavitev zaradi tromboze venskih sinusov
Mateja Repar, Anita Resman Gašperčič
Srečanje dveh velikanov: možganov in imunskega sistema
Matej Markota
eSinapsa, 2013-6
Odstranjevanje možganskih tumorjev pri budnem bolniku
Andrej Vranič, Jasmina Markovič, Blaž Koritnik
Zmedena bolnica, ki nič ne vidi ali PRES
Manja Hribar, Vid Zgonc
Manja Hribar
Netravmatska lokalizirana konveksitetna subarahnoidna krvavitev
Mateja Repar, Fajko F. Bajrović
Sistemska skleroza in ishemična možganska kap - vzročna povezanost ali le koincidenca?
Mateja Repar, Janja Pretnar Oblak
Klemen Grabljevec
Z omejevanjem spodbujajoča terapija pri bolnikih po nezgodni možganski poškodbi
Dejana Zajc, Klemen Grabljevec
eSinapsa, 2014-7
Možgani v mreži navezanosti, ki nas zaznamuje
Barbara Horvat
Vpliv senzoričnega dotoka na uglasitev možganskih povezav
Peter Gradišnik
Človeški konektom ali kakšne so zveze v naših možganih
Blaž Koritnik
Niko Lah
Torkove delavnice za osnovnošolce
Mateja Drolec Novak, Vid V. Vodušek
Da ne pozabim! Tehnike za pomladitev spomina
Klara Tostovršnik, Hana Hawlina
Površina socialne nevroznanosti
Manuel Kuran
Clarity - bistri možgani Karla Deisserotha
Gregor Belušič
Barbara Gnidovec Stražišar
Bojana Žvan
Nevroplastičnost po možganski kapi
Marjan Zaletel
Klinično psihološka obravnava pacientov po možganski kapi in podpora pri vračanju na delovno mesto
Barbara Starovasnik Žagavec
Možgani: organ, s katerim ljubimo
Andraž Matkovič
Marija Šoštarič Podlesnik
Gibalno-kognitivna vadba: praktična delavnica
Mitja Gerževič, Marina Dobnik
Anton Grad
Nevrologija, imunologija, psihiatrija …
Bojan Rojc
Andraž Stožer, Janez Bregant
Dominika Novak Pihler
Možganska kap – »kako ostati v omrežju?«
Nina Ozimic
Klara Tostovršnik
eSinapsa, 2014-8
Znotrajžilno zdravljenje možganskih anevrizem
Tamara Gorjanc, Dimitrij Lovrič
Obravnava hladnih možganskih anevrizem
Bojana Žvan, Janja Pretnar Oblak
Ali deklice z Rettovim sindromom govorijo z očmi?
Anka Slana, Urška Slana
Progresivna multifokalna encefalopatija
Urša Zabret, Katarina Šurlan Popovič
Ne ubijaj – poskusi na živalih
Martina Perše
Poizkusi na živalih - za in proti
Simon Horvat
eSinapsa, 2015-9
Kako deluje navigacijski sistem v naših možganih
Simon Brezovar
Vsakodnevno delo slepe osebe / s slepo osebo
Denis Kamnar
Uroš Marušič
Manca Tekavčič Pompe
Toni Pustovrh
Marko Hawlina
Od svetlobe do podobe ali kako vidijo svet naši možgani
Simon Brezovar
Janja Hrastovšek
Zala Kurinčič
Pogledi na mejno osebnostno motnjo
Jerica Radež, Peter Kapš
Uvid kot socialno psihološki fenomen
Vid Vodušek
Uvod v vidno-prostorske funkcije s praktičnimi primeri
Ana Bujišić, Sanja Roškar
eSinapsa, 2015-10
Difuzijsko magnetnoresonančno slikanje
Rok Berlot
Katja Pavšič
Radiološko izolirani sindrom - ali ga moramo poznati?
Matej Vouk, Katarina Šurlan Popovič
Kako izgledajo možgani, ki govorijo več jezikov?
Gašper Zupan
Nov pristop v rehabilitaciji - terapija s pomočjo psa
Mateja Drljepan
Pogled v maternico z magnetnoresonančno preiskavo
Taja Jordan, Tina Vipotnik Vesnaver
Saša Zorjan
Saša Zorjan
Nevroestetika: ko nevroznanost obišče galerijo
Anja Voljavec, Hana Hawlina, Nika Vrabič
Ali so psihogeni neepileptični napadi res psihogeni?
Saška Vipotnik, Gal Granda
Kako nam lahko glasna glasba »vzame« sluh in povzroči tinitus
Nejc Steiner, Saba Battelino
eSinapsa, 2016-11
Mara Bresjanac
Kako ultrazvok odpira pot v možgane
Kaja Kolmančič
Kako je epigenetika spremenila nevroznanost
Metka Ravnik Glavač
Ondinino prekletstvo ali sindrom prirojene centralne hipoventilacije
Katja Pavšič, Barbara Gnidovec Stražišar, Janja Pretnar Oblak, Fajko F. Bajrović
Zika virus in magnetnoresonančna diagnostika nepravilnosti osrednjega živčevja pri plodu
Rok Banko, Tina Vipotnik Vesnaver
Motnje ravnotežja otrok in odraslih
Nejc Steiner, Saba Battelino
eSinapsa, 2016-12
Vloga magnetnoresonančne spektroskopije pri obravnavi možganskih tumorjev
Gašper Zupan, Katarina Šurlan Popovič
Tiskanje tridimenzionalnih modelov v medicini
Andrej Vovk
Aleš Oblak
Kevin Klarič
Sinestezija: umetnica, ki ne želi odrasti
Tisa Frelih
Računska psihiatrija: od nevroznanosti do klinike
Nastja Tomat
Kognitivni nadzor: od vsakdanjega življenja do bolezni
Vida Ana Politakis
eSinapsa, 2017-13
Internet: nadgradnja ali nadomestek uma?
Matej Perovnik
Vloga črevesnega mikrobioma pri odzivu na stres
Vesna van Midden
Stres pušča posledice tako na človeškem kot živalskem organizmu
Jasmina Kerčmar
Prikaz normalne anatomije in bolezenskih stanj obraznega živca z magnetno resonanco
Rok Banko, Matej Vrabec
Psihedelična izkušnja in njen zdravilni potencial
Anja Cehnar, Jona Basle
Vpliv hiperglikemije na delovanje možganov
Jasna Šuput Omladič, Simona Klemenčič
Nevrofibromatoza: napredujoče obolenje centralnega in perifernega živčevja
Nejc Steiner, Saba Battelino
Fenomen žrtvenega jagnja v dobi interneta
Dolores Trol
Tesnoba staršev in strategije spoprijemanja, ko pri otroku na novo odkrijejo epilepsijo
Daša Kocjančič, Petra Lešnik Musek, Vesna Krkoč, David Gosar
eSinapsa, 2017-14
Zakaj ne zapeljem s ceste, ko kihnem?
Anka Slana Ozimič, Grega Repovš
Nobelova nagrada za odkritje molekularnih mehanizmov nadzora cirkadianih ritmov
Leja Dolenc Grošelj
Možgani pod stresom: od celic do duševnih motenj
Nastja Tomat
Na sledi prvi vzročni terapiji Huntingtonove bolezni
Danaja Metul
Razlike med spoloma pri Parkinsonovi bolezni
Kaja Kolmančič
eSinapsa, 2018-15
Susceptibilno poudarjeno magnetnoresonančno slikanje pri bolniku z ALS
Alja Vičič, Jernej Avsenik, Rok Berlot
Sara Fabjan
Reverzibilni cerebralni vazokonstrikcijski sindrom – pot do diagnoze
Maja Cimperšek, Katarina Šurlan Popovič
Liam Korošec Hudnik
Kognitivno funkcioniranje pri izgorelosti
Marina Horvat
eSinapsa, 2019-16
Maša Čater
Saša Koprivec
Infekcije osrednjega živčnega sistema s flavivirusi
Maja Potokar
Raziskava: Kako depresija vpliva na kognitivne sposobnosti?
Vida Ana Politakis
Razvoj depresije pri otrocih z vidika navezovalnega vedenja
Neža Grgurevič
Sonja Prpar Mihevc
Umetno inteligentna nevroznanost: srečanje nevronskih mrež in možganske fiziologije
Kristijan Armeni
Čebelji strup pri preventivi nevrodegenerativnih bolezni in priložnost za klinično prakso
Matjaž Deželak
eSinapsa, 2019-17
IgG4+ – skupni imenovalec diagnoz iz preteklosti
Cene Jerele, Katarina Šurlan Popovič
Nov molekulski mehanizem delovanja ketamina v astrocitih
Matjaž Stenovec
Praktični pristop k obravnavi utrujenosti in motenj spanja pri bolnikih z multiplo sklerozo
Nik Krajnc, Leja Dolenc Grošelj
Jure Pešak
eSinapsa, 2020-18
Bolezni spektra anti-MOG pri odraslih
Nik Krajnc
Samomor pod lupo nevroznanosti
Alina Holnthaner
eSinapsa, 2020-19
Ob mednarodnem dnevu znakovnih jezikov
Anka Slana Ozimič
Teorija obetov: kako sprejemamo tvegane odločitve
Nastja Tomat
Sara Fabjan
Matjaž Deželak
Nina Stanojević, Uroš Kovačič
Od človeških nevronov do možganskih organoidov – nova obzorja v nevroznanosti
Vesna M. van Midden
Splošna umetna inteligenca ali statistične jezikovne papige?
Kristijan Armeni
Zunajcelični vezikli kot prenašalci zdravilnih učinkovin preko krvno-možganske prepreke
Saša Koprivec
Matjaž Deželak
eSinapsa, 2021-20
Migrena: starodavna bolezen, sodobni pristopi k zdravljenju
Eva Koban, Lina Savšek
Zgodnji razvoj socialnega vedenja
Vesna Jug
Nastja Tomat
Mikrosplet: povezovanje preko mikrobioma
Tina Tinkara Peternelj
Stimulacija možganov kot način zdravljenja depresije
Saša Kocijančič Azzaoui
eSinapsa, 2021-21
eSinapsa, 2022-22
Sodobni vidiki motenj hranjenja
Karin Sernec
Ples in gibalni dialog z malčki
Neva Kralj
Atul Gawande
Jezikovna funkcija pri Alzheimerjevi bolezni
Gašper Tonin
Dostava terapevtikov preko krvno-možganske pregrade
Matjaž Deželak
eSinapsa, 2022-23
Akutni ishemični infarkt hrbtenjače pri zdravih otrocih – kaj lahko pove radiolog?
Katarina Šurlan Popovič, Barbara Šijaković
eSinapsa, 2023-24
Možganska omrežja pri nevrodegenerativnih boleznih
Tomaž Rus, Matej Perovnik
Morske živali kot navdih za nevroznanstvenike: morski konjiček, morski zajček in klobučnjak
Tina Bregant
Metoda Feldenkrais: gibanje in nevroplastičnost
Mateja Pate
Etično naravnana animalna nevroznanost
Maša Čater
Helena Motaln, Boris Rogelj
eSinapsa, 2023-25
Urban Košak, Damijan Knez, Anže Meden, Simon Žakelj, Jurij Trontelj, Jure Stojan, Maja Zakošek Pipan, Kinga Sałat idr.
eSinapsa, 2024-26
Naravno okolje kot vir zdravja in blagostanja
Karin Križman, Grega Repovš, Gaja Zager Kocjan, Gregor Geršak
Katja Peganc Nunčič, Damjan Osredkar
Tanja Goltnik
Ali je zgodnje vstajanje dedno?
Cene Skubic, Laura Plavc, Damjana Rozman, Leja Dolenc Grošelj
eSinapsa, 2024-27
Širša terapevtska uporaba ketamina: potenciali in izzivi
Kristian Elersič
Moč vpliva socialne opore na bolečino
Jana Verdnik
Benjamin Bušelič
Urška Černe, Anemari Horvat, Robert Zorec, Nina Vardjan
eSinapsa, 2025-28
Maša Čater, Nastja Blagovič, Urška Jerič, Agata Kokalj Malovrh, Nuša Balen, Tanja Kunej
Vpliv izobrazbe na skrb za zdravje možganov
Hana Kos, Matej Perovnik
Selena Horvat, Anja Pišlar
Največji rezervoar mikroorganizmov v našem telesu je črevesje, saj v njem prebiva približno 1014 mikroorganizmov 1, biološka združba, ki jo imenujemo mikrobiota. Vse več raziskav odkriva pomembno vlogo mikrobiote pri normalnem delovanju centralnega živčnega sistema ter pri nastanku različnih bolezni možganov (slika 1). Poiskali smo najnovejše ugotovitve s tega področja, ki so jih raziskovalci pridobili v zadnjih letih na podlagi predkliničnih študij na živalskih modelih, kot tudi s kliničnimi študijami na ljudeh.
Dvosmerna komunikacija
V črevesju se nahaja ogromna količina mikrobne biomase, ki je sestavljena iz različnih kompleksnih mikrobnih združb; tako bakterijskih, arhejskih, mikroevkariontskih kot tudi virusnih 1 2. Zgodnja kolonizacija črevesja z mikroorganizmi je izredno pomembna za nadaljnji razvoj osebka, saj vpliva na delovanje možganov in obnašanje. Znanstveniki so s posebnimi poskusi na miših brez črevesne mikrobiote ugotovili, da imajo te miši nepravilno razvito krvno možgansko pregrado, spremenjeno sinaptično plastičnost, oslabljeno socialno obnašanje in oslabljene imunske odzive zaradi nedozorelosti celic mikroglija 3 4 5. Slovenski raziskovalci so ugotovili, da v odrasli dobi na črevesno okolje in lastnosti mikrobiote v njem vplivata način prehranjevanja in fizična aktivnost 6. Kako zdravo črevesno mikrobioto imamo v črevesju pa vpliva ne le na gastrointestinalni trakt, temveč tudi na druge organe 7.
Različne predklinične in klinične raziskave so pokazale, da so s sestavo in delovanjem črevesne mikrobiote močno povezane avtoimunske, presnovne in nevrodegenerativne bolezni, pojavnost depresije ter tudi rak 8 9 10. Natančni mehanizmi delovanja osi mikrobiota–črevesje–možgani na razvoj bolezni možganov še niso poznani. Kot kažejo raziskave, os deluje precej kompleksno, saj se mikrobiota za komunikacijo z možgani (in obratno) poslužuje različnih načinov, in sicer preko živčnih, endokrinih, imunskih in presnovnih poti. Tako komunikacija med črevesjem in možgani poteka s pošiljanjem signalov po naslednjih poteh 11:
a) od črevesja do možganov:
- po vagusnem živcu 17 in aferentnih živcih v hrbtenjači
- preko krvožilnega sistema z imunskimi mediatorji (citokini), črevesnimi hormoni in mikrobnimi metaboliti ter
b) od možganov do črevesja:
- preko aktivacije hipotalamusno-hipofizne-adrenalne (HPA) osi z nevroendokrinimi faktorji
- po simpatičnih in parasimpatičnih eferentnih živcih
in je pravzaprav dvosmerna 12. Na podlagi teh kompleksnih poti črevesni mikrobi regulirajo presnovo osebka in njegov imunski ter žilni sistem 13, s tem pa vplivajo na zdravje možganov in nastanek možganskih bolezni; hkrati pa možgani v obratni smeri vplivajo na samo aktivnost črevesne mikrobiote in na to, kako močno mikrobiota sodeluje v komunikacijski osi med možgani in črevesjem.
Vagusni živec in krvožilni sistem. Dosedanje raziskave kažejo, da je vagusni živec (slika 2) povezan s pojavom tako akutnih kot tudi kroničnih bolezni možganov, ni pa še natančno znano, kako dejansko povezuje črevesno mikrobioto z razvojem posameznega možganskega obolenja 14 15. Mikrobni metaboliti lahko povzročijo vnetje v možganih tudi s pomočjo krvožilnega sistema (slika 2) preko vzpostavitve citokinske kaskade, kar povzroči spremembe v možganskih procesih in vpliva na počutje in vedênje 16.
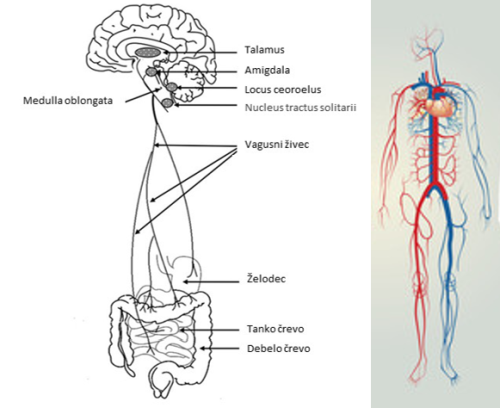
Slika 2: Shematski prikaz povezanosti možganov in črevesja z vagusnim živcem (levo, prirejeno po 17) in krvožilnega sistema (desno, Adobe Stock).
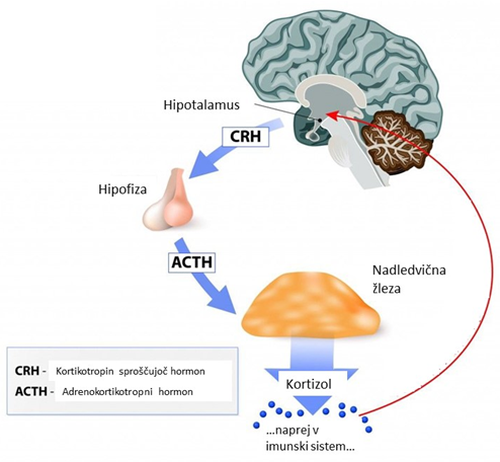
Os hipotalamus–hipofiza–nadledvična žleza. Črevesna mikrobiota pa komunicira tudi z nevroendokrinim sistemom, ki nadzira telesni odziv na fiziološki ali psihološki stres, vključno z vnetji. Gre za os HPA (slika 3) 19. Ob normalnem delovanju osi se ob pojavu stresnega dejavnika iz paraventrikularnega jedra v hipotalamusu v možganih sprosti kortikotropin-sproščujoči hormon. To povzroči sproščanje adrenokortikotropnega hormona v krvožilni sistem, slednje pa v nadledvični žlezi aktivira izločanje glukokortikoidov (kortizol pri ljudeh, kortikosteron pri glodalcih). Sprostitev glukokortikoidov povzroči povratno zanko, saj z vezavo na glukokortikoidne receptorje v možganih glukokortikoidi inhibirajo aktivirano os in zaustavijo odziv na stres. Hipotalamus in hipofiza v možganih ter nadledvična žleza sodelujejo tudi z drugimi sistemi v telesu: z imunskim sistemom, s črevesno steno (prehajanje mikrobnih metabolitov in hormonov), krvno-možgansko pregrado in senzoričnim ter avtonomnim živčnim sistemom 18. Pri nekaterih obolenjih, kot sta depresija in sindrom razdražljivega črevesja, so raziskovalci zaznali porušeno ravnovesje tako v črevesni mikrobioti kot v delovanju osi HPA. Pri obeh obolenjih so potrdili povečano aktivnost osi HPA, torej pretiran telesni stresni odziv, najverjetneje zaradi vnetnih procesov v črevesju ali drugod v telesu. Gre za posledico vpliva črevesne mikrobiote na os HPA. Komunikacija pa poteka tudi v obratni smeri. Aktivacija osi HPA lahko vpliva na sestavo črevesne mikrobiote preko povečanja permeabilnost črevesne stene 18.
Črevesna mikrobiota ter kronične/akutne bolezni možganov
Raziskave na področju razvoja bolezni možganov na podlagi povezanosti črevesja in možganov so že večkrat pokazale, da je črevesna mikrobiota povezana z nekaterimi nevrodegenerativnimi boleznimi (najpogosteje gre za Alzheimerjevo in Parkinsonovo bolezen), razvojem depresije in tudi akutnimi boleznimi možganov, kot je možganska kap. Pri vseh teh obolenjih se v črevesju pojavljata porušeno ravnovesje mikrobne populacije (t. i. disbioza), ki vodi v vnetne procese, in poslabšana gibljivost črevesja, medtem ko v možganih prihaja do smrti nevronov, aktivacije celic mikroglija, posledice pa se kažejo tudi v vedenjskih motnjah 20.
Možganska kap. Pri možganski kapi v možganih nastanejo lezije, povezana pa je tudi z izrednimi spremembami v mikrobni kompoziciji v črevesju 21. Porušeno ravnovesje v črevesju nato sproža nadaljnje vnetne procese v možganih, ki se pojavijo po kapi. Za namene razvoja terapije se v zadnjih letih veliko raziskuje potencial transplantacije fecesa. Spychala in sod. 22 so starim mišim, ki so doživele možgansko kap, transplantirali feces mladih miši, ki je vseboval populacije mikrobiote v zdravem ravnovesju. Rezultati so bili izredno zanimivi, saj so s fekalno transplantacijo uspeli zmanjšati sistemsko vnetje in zmanjšati celokupne posledice možganske kapi.
Alzheimerjeva bolezen. Ravno obraten učinek destabilizacije črevesne mikrobiote se kaže pri mišjih modelih Alzheimerjeve bolezni. Miši, tretirane z antibiotiki, so izkazovale ne le spremenjeno črevesno mikropopulacijo, temveč tudi zmanjšano nalaganje β-amiloidov v možganih, ki povzročajo degeneracijo nevronov in upad kognicije. Terapiji z antibiotiki je sledila transplantacija fecesa kontrolnih miši, ki je ponovno vzpostavila stabilno črevesno mikrobioto in pozitivno vplivala tudi na delno obnovitev možganov. Ob tem se je aktivacija celic mikroglija zmanjšala 23.
Parkinsonova bolezen. Korenita sprememba in uničenje dosedanje črevesne mikrobiote se kažeta kot izjemno učinkoviti metodi tudi pri omiljevanju negativnih posledic Parkinsonove bolezni pri miših. Rezultati so zmanjšana aktivacija celic mikroglija, izboljšanje gibljivosti telesa in manjše kopičenje α-sinukleinov v možganih. Pri tem je zanimivo, da se simptomi Parkinsonove bolezni povrnejo, če miš nato sprejme transplantacijo fecesa druge obolele miši 24.
Komunikacijske molekule
Kako pa se mikroorganizmi v črevesju pravzaprav »pogovarjajo« z možgani? V črevesju je stalno prisotna velika količina mikrobnih metabolitov, s pomočjo katerih mikrobiota komunicira z gostiteljevim telesom. V tej heterogeni poplavi molekul jih majhen delež preko krvi, po humoralni poti, preko imunskega sistema ali pa preko nevronov vpliva na gostiteljevo nevrofiziologijo in spreminja njegove možgane ter vedênje 20.
Kratkoverižne maščobne kisline. V črevesju mikrobi hrano razgradijo in pri tem proizvedejo kratkoverižne maščobne kisline (KMK), kot so acetat, propionat in butirat, ki veljajo za ene izmed glavnih komunikacijskih molekul mikrobioma (slika 4). Te KMK v črevesju vplivajo na zmanjšanje količine vnetnih citokinov in kontrolirajo nivo črevesnih hormonov in nevro-peptidov ter s tem tudi delovanje možganov 25. Dokazan je bil njihov vpliv na razvoj celic mikroglija in integriteto krvno-možganske pregrade 9. Povezujejo jih tudi z nastankom patologije pri Parkinsonovi bolezni, saj so raziskovalci v fecesu pacientov s Parkinsonovo boleznijo odkrili drugačne vsebnosti KMK v črevesju kot pri enako starih ljudeh brez te bolezni 26. Ho in sod. so raziskovali vpliv črevesnih KMK na razvoj Alzheimerjeve bolezni in ugotovili, da imajo nekatere KMK izredno koristno in zaščitno vlogo. Valerična in butirična kislina, ki ju proizvajajo črevesni mikrobi, sta močno inhibirali oblikovanje peptidov v nevrotoksične β-amiloide v in vitro poskusih 27.
Triptofan. Poleg KMK v črevesju nastajajo tudi metaboliti triptofana. Triptofan je ena izmed esencialnih aminokislin, ki jo pridobimo iz prehrane. Metaboliti triptofana vplivajo na imunsko delovanje črevesja. Raziskave kažejo, da spremenjena razgradnja triptofana moti serotonergično signalizacijo in povzroča nastanek duševnih obolenj, najpogosteje depresijo 28. Motnje v metabolizmu triptofana so povezane tudi s hujšimi oblikami možganske kapi preko aktivacije vnetnih procesov po kapi 29. Prav tako je bil spremenjen metabolizem triptofana zaznan pri Parkinsonovih pacientih 30, vendar vloga triptofanovih metabolitov pri nastanku vnetij pri možganskih obolenjih še ni natančno razjasnjena.
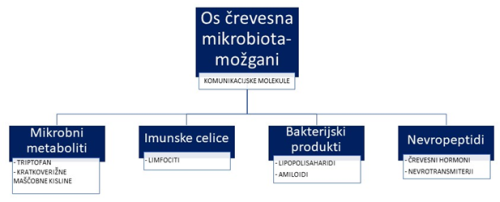
Slika 4: Shematični prikaz molekul, ki sodelujejo pri dvosmerni komunikaciji med možgani in črevesjem.
Limfociti. Za homeostazo mikrobnih metabolitov skrbijo imunske celice T, ki jih delimo na regulatorne in efektorske. V primeru vnetnih bolezni se ravnovesje med njuno zaščitno funkcijo in imunskim odzivom poruši. Povečana prisotnost efektorskih celic T in zmanjšana prisotnost regulatornih celic T vodita v vnetne procese 31. Na tak način delujejo limfociti T, ki imajo izredno pomembno vlogo pri razvoju možganske kapi. Efektorski limfociti T povzročajo vnetja in razvoj lezij v možganih, medtem ko protivnetni, regulatorni limfociti T zmanjšujejo vnetne procese, ki nastanejo pri kapi, zato jih štejemo med nevroprotektante 32. Analize mikrobne disbioze v črevesju kot posledica možganske kapi so pokazale na večje število efektorskih celic T v črevesju kot tudi v možganih 21. Sodelovanje mikrobiote v črevesju z imunskimi celicami T je primarnega pomena za razvoj posledic po možganski kapi. Tako bakterije v črevesju posredno delujejo nevroprotektivno, saj z vezavo na dendritske celice, ki tudi sodelujejo v imunskem odzivu, promovirajo ekspanzijo regulatornih celic T v črevesju in s tem izločanje molekul za utišanje efektorskih celic T in vnetja. Bakterijsko posredovanje v črevesju se kaže tudi v možganih, saj celice T migrirajo iz črevesja proti možganskim ovojnicam 33.
Bakterijski lipopolisaharidi in amiloidi. Poleg mikrobnih metabolitov v črevesju in imunskih celic pa na gostiteljev imunski sistem in nastanek nevroloških obolenj lahko vplivajo tudi lipopolisaharidi in amiloidni proteini. Gram-negativne bakterije v črevesju izločajo endotoksin lipopolisaharid, za katerega je znano, da pospešuje akumulacijo β-amiloidov v možganih miši in povzroča kognitivne težave. Lipopolisaharidi lahko prehajajo črevesje in potujejo po telesu, s čimer povzročijo močan imunski odziv, poškodujejo krvno možgansko pregrado in možgane ter aktivirajo celice mikroglija 20 34. Kopičenje amiloidnih proteinov v možganih, kar ima ključno vlogo pri nastanku nevrodegenerativnih bolezni, pa je kot kaže povezano z amiloidi, ki jih nekatere črevesne bakterije sintetizirajo za gradnjo biofilmov 35.
Nevropeptidi. Številni biološko aktivni peptidi, kot so substanca P, s kalcitoninskim genom povezan peptid, nevropeptid Y, vazoaktivni črevesni polipeptidi, somatostatin in kortikotropin-sproščujoč faktor delujejo tako kot nevrotransmiterji, kakor tudi kot črevesni hormoni, saj ciljajo na enake membranske receptorje 11. Njihova naloga v komunikaciji med možgani in črevesjem še ni natančno razjasnjena, znano pa je, da vplivajo na aktivnost črevesne mikrobiote in s tem na moč mikrobne komunikacije na osi črevesje–možgani.
Zaključek
Raziskave se nadaljujejo in odkrivajo vedno nove povezave med črevesnim mikrobiomom in možgani. Močna čustva, kot so jeza, strah, stres, žalost ali navdušenje, ki izvirajo v možganih, lahko povzročijo spremembe v črevesju in prebavi, kar pozna vsak od nas. Ker pa je komunikacija dvosmerna, tudi črevesna mikrobiota neprestano komunicira z našimi možgani in vzdržuje zdravje celotnega telesa. Mikrobiom tako direktno vpliva na naše fizično zdravje, hkrati pa tudi na duševno. Mikroorganizmi v črevesju in njihovi metaboliti lahko povzročijo nastanek nevroloških in psihiatričnih obolenj, kot so epilepsija, avtizem, shizofrenija, ali pa vplivajo na njihov razvoj in potek – s čimer oblikujejo našo osebnost. Tako pravzaprav MIKROorganizmi v možganih povzročajo MAKRO posledice.
-
___
-
Sekirov, I. 2010. Gut microbiota in health and disease. Physiology Reviews, 90(3): 859-904. ↩
-
Gilbert, J. A., Blaser, M. J., Caporaso, J. G., Jansson, J. K., Lynch, S. V., Knight, R. 2018. Current understanding of the human microbiome. Nature Medicine, 24: 392-400. ↩
-
Sampson, T. R., Mazmanian, S. K. 2015. Control of brain development, function, and behavior by the microbiome. Cell Host Microbe, 17: 565-576. ↩
-
Erny, D., Hrabe de Angelis, A. L., Jaitin, D., Weighofer, P., Staszewski, O., David, E., Keren-Shaul, H., Mahlakoiv, T., Jakobshagen, K., Buch, T. 2015. Host microbiota constantly control maturation and function of microglia in the CNS. Nature Neuroscience, 18: 965-977. ↩
-
Chu, C., Murdock, M. H., Jing, D., Won, T. H., Chung, H., Kressel, A. M., Tsaava, T., Addorisio, M. E., Putzel, G. G., Zhou, L. 2019. The microbiota regulate neuronal function and fear extinction learning. Nature, 574: 543-548. ↩
-
Šket, R. 2018. Physical inactivity related changes in human fecal microbiota. Doctoral dissertation, University of Ljubljana: 102. ↩
-
Sommer, F., Backhed, F. 2013. The gut microbiota – masters of host development and physiology. Nature Medicine, 11: 227-238. ↩
-
Kamada, N., Seo, S.-U., Chen, G. Y., Nunez, G. 2013. Role of the gut microbiota in immunity and inflammatory disease. Nature Reviews in Immunology, 13: 321-335. ↩
-
Duvallet, C., Gibbons, S. M., Gurry, T., Irizarry, R. A., Alm, E. J. 2017. Meta-analysis of gut microbiome studies identifies disease-specific and shared responses. Nature Communications, 8, Article 1784. ↩
-
Du, Y., Gao, X.-R., Peng, L., Ge, J.-F. 2020. Crosstalk between the microbiota-gut-brain axis and depression. Heliyon, 6(6): e04097. ↩
-
Holzer, P., Farzi, A. 2014. Neuropeptides and the microbiota-gut-brain axis. Micriobial Endocrinology: The microbiota-Gut-Brain Axis in Health and Disease. Advances in Experimental Medicine and Biology. Springer, New York. 817: 195-219. ↩
-
Breit, S., Kupferberg, A., Rogler, G., Hasler, G. 2018. Vagus nerve as modulator of the brain-gut axis in psychiatric and inflammatory disorders. Frontiers in Psychiatry, 13(9): 44. ↩
-
Spielman, L. J., Gibson, D. L., Klegeris, A. 2018. Unhelathy gut, unhelathy brain: the role of the intestinal microbiota in neurodegenerative diseases. Neurochemistry International, 120: 149-163. ↩
-
Cryan, J. F., O’Riordan, K. J., Cowan, C. S. M., Sandhu, K. V., Bastiaanssen, T. F. S., Boehme, M., Codagnone, M. G., Cussotto, S., Fulling, C., Golubeva, A. V. 2019. The microbiota-gut-brain axis. Physiology Reviews, 99: 1877-2013. ↩
-
Hays, S. A., Ruiz, A., Bethea, T., Khodoparast, N., Carmel, J. B., Rennaker, R. L. I. I., Kilgard, M. P. 2016. Vagus nerve stimulation during rehabilitative training enhances recovery of forelimb function after ischemic stroke in aged rats. Neurobiology of Aging, 43: 111-118. ↩
-
Kaczmarczyk, R., Tejera, D., Simon, B. J., Heneka, M. T. 2018. Microglia modulation through external vagus nerve stimlation in a murine model of Alzheimer’s disease. Journal of Neurochemistry, 146: 76-85. ↩
-
Federico, A. 2017. Gut microbiota and the liver. Minerva Gastroenterology and Dietology, 63(4): 385-398. ↩
-
Taylor, M. Is depression in your genes? Understanding the genetic factors of depression. https://medium.com/@mike.s.taylor101/is-depression-in-your-genes-6987c848fde8 (30.12.2020) ↩
-
Farzi, A., Frohlich, E. E., Holzer, P. 2018. Gut microbiota and the neuroendocrine system. Neurotherapeutics, 15(1): 5-22. ↩
-
Benakis, C., Martin-Gallausiaux, C. M., Trezzi, J.-P., Melton, P., Liesz, A., Wilmes, P. 2020. The microbiome-gut-brain axis in acute and chronic brain diseases. Current Opinion in Neurobiology, 61: 1-9. ↩
-
Singh, V., Roth, S., Llovera, G., Sadler, R., Garzetti, D., Stecher, B., Dichgans, M., Liesz, A. 2016. Microbiota dysbiosis controls the neuroinflammatory response after stroke. Journal of Neuroscience, 36: 7428-7440. ↩
-
Spychala, M. S., Venna, V. R., Jandzinski, M., Doran, S. J., Durgan, D. J., Ganesh, B. P., Ajami, N. J., Putluri, N., Graf, J., Bryan, R. M. 2018. Age-related changes in the gut microbiota influence systemic inflammation and stroke outcome. Annals of Neurology, 84: 23-36. ↩
-
Minter, M. R., Znang, C., Leone, V., Ringus, D. L., Zhang, X., Oyler-Castrillo, P., Musch, M. W., Liao, F., Ward, J. F., Holtzman, D. M. 2016. Antibiotic-induced perturbations in gut microbial diversity influences neuro-inflammation and amyloidosis in a murine model of Alzheimer’s disease. Scientific Reports, 6: 30028. ↩
-
Sampson, T. R., Debelius, J. W., Thron, T., Janssen, S., Shastri, G. G., Ilhan, Z. E., Challis, C., Schretter, C. E., Rocha, S., Gradinaru, V. 2016. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson’s disease. Cell, 167: 1469-1480. ↩
-
Dalile, B., Van Oudenhove, L., Vervliet, B., Verbeke, K. 2019. The role of shot-chain fatty acids in microbiota-gut-brain communication. Nature Reviews Gatroenterology & Hepatology, 16: 461-478. ↩
-
Unger, M. M., Spiegel, J., Dillmann, K.-U., Grundmann, D., Philippeit, H., Burmann, J., Fassbender, K., Schwiertz, A., Schafer, K.-H. 2016. Short chain fatty acids and gut microbiota differ between patients with Parkinson’s disease and age-matched controls. Parkinsonism Related Disorders, 32: 66-72. ↩
-
Ho, L., Ono, K., Tsuji, M., Mazzola, P., Singh, R., Pasinetti, G. M. 2018. Protective roles of intestinal microbiota derived short chain fatty acids in Alzheimer’s disease-type beta-amyloid neuropathological mechanisms. Expert Review of Neurotherapeutics, 18(1): 83-90. ↩
-
Waclawikova, B., El Aidy, S. 2018. Role of microbiota and tryptophan metabolites in the remote effect of intestinal inflammation on brain and depression. Pharmaceuticals (Basel), 11(3): 63. ↩
-
Ormstad, H., Verker, R., Aass, H. C. D., Amthor, K.-F., Sandvik, L. 2013. Inflammation-induced catabolism of tryptophan and tyrosine in acute ischemic stroke. Journal of Molecular Neuroscience, 51: 893-902. ↩
-
Szabo, N., Kincses, Z. T., Toldi, J., Vecsei, L. 2011. Altered tryptophan metabolism in Parkinson’s disease: a possible novel therapeutic approach. Journal of Neurological Sciences, 310: 256-260. ↩
-
Ivanov, I. I., Littman, D. R. 2011. Modulation of immune homeostasis by commensal bacteria. Current Opinions in Microbiology, 14: 106-114. ↩
-
Liesz, A., Suri-Payer, E., Veltkamp, C., Doerr, H., Sommer, C., Rivest, S., Giese, T., Veltkamp, R. 2009. Regulatory T cells are key cerebroprotective immunomulators in acute experimental stroke. Nature Medicine, 15: 192-199. ↩
-
Benakis, C., Brea, D., Caballer, S., Faraco, G., Moore, J., Murphy, M., Sita, G., Racchumi, G., Ling, L., Pamer, E. G. 2016. Commensal microbiota affects ischemic stroke outcome by regulating intestinal γδ T cells. Nature Medicine, 22: 516-523. ↩
-
Zhan, X., Stamova, B., Jin, L.-W., DeCarli, C., Phinney, B., Sharp, F. R. 2016. Gram-negative bacterial molecules associate with Alzheimer disease pathology. Neurology, 87(22): 2324-2332. ↩
-
Lundmark, K., Westermark, G. T., Olsen, A., Westermark, P. 2005. Protein fibrils in nature can enhance amyloid protein A amyloidosis in mice: cross-seeding as a disease mechanism. Proceedins of National Academy of Science USA, 102: 6098-6102. ↩
dr. Maša Čater
Inštitut za fiziologijo
Medicinska fakulteta
Univerza v Mariboru