Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Fosforilacija 526Tyr proteina FUS spremeni njegovo jedrno-citoplazemsko razporeditev pri FTLD-FUS obolenju
članki
eSinapsa, 2011-1
Zvezdan Pirtošek
Eksoskeleti – inteligentne bionske naprave
Marko Munih
O aktualnih dilemah draženja globokih možganskih struktur pri obsesivno - kompulzivni motnji
Nadja Jarc
Sledite svojo srečo ... z iPhone
Urban Kordeš
eSinapsa, 2011-2
Renata Salecl
Gašper Tkačik
Astrociti – spregledane zvezde nevrobiologije
Marko Kreft, Robert Zorec
Sašo Dolenc
Meditacija - malo truda, veliko koristi
Luka Dimic
eSinapsa, 2011-3
Mara Bresjanac
Martina Starc
Rok Berlot
Varnost uporabe generičnih protiepileptičnih zdravil
Mojca Kržan, Matevž Kržan
Možgani, računalniki - nekaj vmes
Miha Pelko
eSinapsa, 2012-4
Ali so moški in ženski možgani različni?
Gregor Majdič
O kognitivnih motnjah pri bolnikih s Parkinsonovo boleznijo
Dejan Georgiev
Akutno možgansko kap lahko uspešno zdravimo
Nina Vujasinovič, Bojana Žvan
Vloga nevropsihološke diagnostike pri odkrivanju zgodnjih znakov alzheimerjeve bolezni
Simon Brezovar
eSinapsa, 2013-5
Subarahnoidna krvavitev zaradi tromboze venskih sinusov
Mateja Repar, Anita Resman Gašperčič
Srečanje dveh velikanov: možganov in imunskega sistema
Matej Markota
Novo odkritje na področju sporadičnih prionskih bolezni
Jana Jerše, Nadja Jarc
Učinek placeba brez lažnih zdravil in zavajanja
Mara Bresjanac
eSinapsa, 2013-6
Odstranjevanje možganskih tumorjev pri budnem bolniku
Andrej Vranič, Jasmina Markovič, Blaž Koritnik
Zmedena bolnica, ki nič ne vidi ali PRES
Manja Hribar, Vid Zgonc
Manja Hribar
Sistemska skleroza in ishemična možganska kap - vzročna povezanost ali le koincidenca?
Mateja Repar, Janja Pretnar Oblak
Netravmatska lokalizirana konveksitetna subarahnoidna krvavitev
Mateja Repar, Fajko F. Bajrović
Klemen Grabljevec
Z omejevanjem spodbujajoča terapija pri bolnikih po nezgodni možganski poškodbi
Dejana Zajc, Klemen Grabljevec
eSinapsa, 2014-7
Možgani v mreži navezanosti, ki nas zaznamuje
Barbara Horvat
Vpliv senzoričnega dotoka na uglasitev možganskih povezav
Peter Gradišnik
Človeški konektom ali kakšne so zveze v naših možganih
Blaž Koritnik
Niko Lah
Torkove delavnice za osnovnošolce
Mateja Drolec Novak, Vid V. Vodušek
Da ne pozabim! Tehnike za pomladitev spomina
Klara Tostovršnik, Hana Hawlina
Površina socialne nevroznanosti
Manuel Kuran
Clarity - bistri možgani Karla Deisserotha
Gregor Belušič
Barbara Gnidovec Stražišar
Bojana Žvan
Nevroplastičnost po možganski kapi
Marjan Zaletel
Klinično psihološka obravnava pacientov po možganski kapi in podpora pri vračanju na delovno mesto
Barbara Starovasnik Žagavec
Možgani: organ, s katerim ljubimo
Andraž Matkovič
Marija Šoštarič Podlesnik
Gibalno-kognitivna vadba: praktična delavnica
Mitja Gerževič, Marina Dobnik
Anton Grad
Nevrologija, imunologija, psihiatrija …
Bojan Rojc
Andraž Stožer, Janez Bregant
Dominika Novak Pihler
Možganska kap – »kako ostati v omrežju?«
Nina Ozimic
Klara Tostovršnik
eSinapsa, 2014-8
Znotrajžilno zdravljenje možganskih anevrizem
Tamara Gorjanc, Dimitrij Lovrič
Obravnava hladnih možganskih anevrizem
Bojana Žvan, Janja Pretnar Oblak
Ali deklice z Rettovim sindromom govorijo z očmi?
Anka Slana, Urška Slana
Progresivna multifokalna encefalopatija
Urša Zabret, Katarina Šurlan Popovič
Ne ubijaj – poskusi na živalih
Martina Perše
Poizkusi na živalih - za in proti
Simon Horvat
eSinapsa, 2015-9
Kako deluje navigacijski sistem v naših možganih
Simon Brezovar
Vsakodnevno delo slepe osebe / s slepo osebo
Denis Kamnar
Uroš Marušič
Manca Tekavčič Pompe
Toni Pustovrh
Marko Hawlina
Od svetlobe do podobe ali kako vidijo svet naši možgani
Simon Brezovar
Janja Hrastovšek
Zala Kurinčič
Pogledi na mejno osebnostno motnjo
Jerica Radež, Peter Kapš
Uvid kot socialno psihološki fenomen
Vid Vodušek
Uvod v vidno-prostorske funkcije s praktičnimi primeri
Ana Bujišić, Sanja Roškar
eSinapsa, 2015-10
Difuzijsko magnetnoresonančno slikanje
Rok Berlot
Katja Pavšič
Radiološko izolirani sindrom - ali ga moramo poznati?
Matej Vouk, Katarina Šurlan Popovič
Kako izgledajo možgani, ki govorijo več jezikov?
Gašper Zupan
Nov pristop v rehabilitaciji - terapija s pomočjo psa
Mateja Drljepan
Pogled v maternico z magnetnoresonančno preiskavo
Taja Jordan, Tina Vipotnik Vesnaver
Saša Zorjan
Saša Zorjan
Nevroestetika: ko nevroznanost obišče galerijo
Anja Voljavec, Hana Hawlina, Nika Vrabič
Ali so psihogeni neepileptični napadi res psihogeni?
Saška Vipotnik, Gal Granda
Kako nam lahko glasna glasba »vzame« sluh in povzroči tinitus
Nejc Steiner, Saba Battelino
eSinapsa, 2016-11
Mara Bresjanac
Kako ultrazvok odpira pot v možgane
Kaja Kolmančič
Kako je epigenetika spremenila nevroznanost
Metka Ravnik Glavač
Ondinino prekletstvo ali sindrom prirojene centralne hipoventilacije
Katja Pavšič, Barbara Gnidovec Stražišar, Janja Pretnar Oblak, Fajko F. Bajrović
Motnje ravnotežja otrok in odraslih
Nejc Steiner, Saba Battelino
Zika virus in magnetnoresonančna diagnostika nepravilnosti osrednjega živčevja pri plodu
Rok Banko, Tina Vipotnik Vesnaver
eSinapsa, 2016-12
Vloga magnetnoresonančne spektroskopije pri obravnavi možganskih tumorjev
Gašper Zupan, Katarina Šurlan Popovič
Tiskanje tridimenzionalnih modelov v medicini
Andrej Vovk
Aleš Oblak
Kevin Klarič
Sinestezija: umetnica, ki ne želi odrasti
Tisa Frelih
Računska psihiatrija: od nevroznanosti do klinike
Nastja Tomat
Kognitivni nadzor: od vsakdanjega življenja do bolezni
Vida Ana Politakis
eSinapsa, 2017-13
Internet: nadgradnja ali nadomestek uma?
Matej Perovnik
Vloga črevesnega mikrobioma pri odzivu na stres
Vesna van Midden
Stres pušča posledice tako na človeškem kot živalskem organizmu
Jasmina Kerčmar
Prikaz normalne anatomije in bolezenskih stanj obraznega živca z magnetno resonanco
Rok Banko, Matej Vrabec
Psihedelična izkušnja in njen zdravilni potencial
Anja Cehnar, Jona Basle
Vpliv hiperglikemije na delovanje možganov
Jasna Šuput Omladič, Simona Klemenčič
Nevrofibromatoza: napredujoče obolenje centralnega in perifernega živčevja
Nejc Steiner, Saba Battelino
Fenomen žrtvenega jagnja v dobi interneta
Dolores Trol
Tesnoba staršev in strategije spoprijemanja, ko pri otroku na novo odkrijejo epilepsijo
Daša Kocjančič, Petra Lešnik Musek, Vesna Krkoč, David Gosar
eSinapsa, 2017-14
Zakaj ne zapeljem s ceste, ko kihnem?
Anka Slana Ozimič, Grega Repovš
Nobelova nagrada za odkritje molekularnih mehanizmov nadzora cirkadianih ritmov
Leja Dolenc Grošelj
Možgani pod stresom: od celic do duševnih motenj
Nastja Tomat
Na sledi prvi vzročni terapiji Huntingtonove bolezni
Danaja Metul
Razlike med spoloma pri Parkinsonovi bolezni
Kaja Kolmančič
eSinapsa, 2018-15
Susceptibilno poudarjeno magnetnoresonančno slikanje pri bolniku z ALS
Alja Vičič, Jernej Avsenik, Rok Berlot
Sara Fabjan
Reverzibilni cerebralni vazokonstrikcijski sindrom – pot do diagnoze
Maja Cimperšek, Katarina Šurlan Popovič
Liam Korošec Hudnik
Kognitivno funkcioniranje pri izgorelosti
Marina Horvat
eSinapsa, 2019-16
Maša Čater
Saša Koprivec
Infekcije osrednjega živčnega sistema s flavivirusi
Maja Potokar
Raziskava: Kako depresija vpliva na kognitivne sposobnosti?
Vida Ana Politakis
Razvoj depresije pri otrocih z vidika navezovalnega vedenja
Neža Grgurevič
Sonja Prpar Mihevc
Umetno inteligentna nevroznanost: srečanje nevronskih mrež in možganske fiziologije
Kristijan Armeni
Čebelji strup pri preventivi nevrodegenerativnih bolezni in priložnost za klinično prakso
Matjaž Deželak
eSinapsa, 2019-17
IgG4+ – skupni imenovalec diagnoz iz preteklosti
Cene Jerele, Katarina Šurlan Popovič
Nov molekulski mehanizem delovanja ketamina v astrocitih
Matjaž Stenovec
Praktični pristop k obravnavi utrujenosti in motenj spanja pri bolnikih z multiplo sklerozo
Nik Krajnc, Leja Dolenc Grošelj
Jure Pešak
eSinapsa, 2020-18
Bolezni spektra anti-MOG pri odraslih
Nik Krajnc
Samomor pod lupo nevroznanosti
Alina Holnthaner
eSinapsa, 2020-19
Ob mednarodnem dnevu znakovnih jezikov
Anka Slana Ozimič
Teorija obetov: kako sprejemamo tvegane odločitve
Nastja Tomat
Sara Fabjan
Matjaž Deželak
Nina Stanojević, Uroš Kovačič
Od človeških nevronov do možganskih organoidov – nova obzorja v nevroznanosti
Vesna M. van Midden
Splošna umetna inteligenca ali statistične jezikovne papige?
Kristijan Armeni
Zunajcelični vezikli kot prenašalci zdravilnih učinkovin preko krvno-možganske prepreke
Saša Koprivec
Matjaž Deželak
eSinapsa, 2021-20
Migrena: starodavna bolezen, sodobni pristopi k zdravljenju
Eva Koban, Lina Savšek
Zgodnji razvoj socialnega vedenja
Vesna Jug
Nastja Tomat
Mikrosplet: povezovanje preko mikrobioma
Tina Tinkara Peternelj
Stimulacija možganov kot način zdravljenja depresije
Saša Kocijančič Azzaoui
eSinapsa, 2021-21
eSinapsa, 2022-22
Sodobni vidiki motenj hranjenja
Karin Sernec
Ples in gibalni dialog z malčki
Neva Kralj
Atul Gawande
Jezikovna funkcija pri Alzheimerjevi bolezni
Gašper Tonin
Dostava terapevtikov preko krvno-možganske pregrade
Matjaž Deželak
eSinapsa, 2022-23
Akutni ishemični infarkt hrbtenjače pri zdravih otrocih – kaj lahko pove radiolog?
Katarina Šurlan Popovič, Barbara Šijaković
eSinapsa, 2023-24
Možganska omrežja pri nevrodegenerativnih boleznih
Tomaž Rus, Matej Perovnik
Morske živali kot navdih za nevroznanstvenike: morski konjiček, morski zajček in klobučnjak
Tina Bregant
Metoda Feldenkrais: gibanje in nevroplastičnost
Mateja Pate
Etično naravnana animalna nevroznanost
Maša Čater
Helena Motaln, Boris Rogelj
eSinapsa, 2023-25
Urban Košak, Damijan Knez, Anže Meden, Simon Žakelj, Jurij Trontelj, Jure Stojan, Maja Zakošek Pipan, Kinga Sałat idr.
eSinapsa, 2024-26
Naravno okolje kot vir zdravja in blagostanja
Karin Križman, Grega Repovš, Gaja Zager Kocjan, Gregor Geršak
Katja Peganc Nunčič, Damjan Osredkar
Raziskovalci iz Slovenije smo v povezavi z nevropatologi iz Nemčije in Nizozemske v članku, objavljenem v ugledni reviji Brain, okarakterizirali post-translacijsko modifikacijo (spremembo) – fosforilacijo proteina FUS na zadnjem C-terminalnem aminokislinskem ostanku, ki je udeležena pri zgodnjem razvoju obolenja frontotemporalne lobularne demence (FTLD). Izsledki raziskave omogočajo nov pomemben vpogled v vzroke nastanka FTLD in razvoj novih strategij za zdravljenje te bolezni.
RNA-vezavni protein FUS: gradnik agregatov pri nevrodegenerativnih obolenjih
Za nevrodegenerativne bolezni, kot je demenca, je značilno odmiranje živčnih celic. V možganih teh bolnikov prihaja do nenormalnega kopičenja nekaterih proteinov na napačni subcelični lokaciji (citoplazmi) v živčnih celicah, kar vodi v njihovo smrt. Do kopičenja teh proteinov pride zaradi sprememb, ki se zgodijo v proizvodnji teh proteinov, pri njihovem razporejanju, agregaciji in razgradnji. Z različnimi genomskimi pristopi so bile odkrite mutacije v genih številnih RNA-vezavnih proteinov (RBP), ki so povezani s patogenezo dveh prekrivajočih, klinično heterogenih nevrodegenerativnih bolezni, amiotrofično lateralno sklerozo (ALS) in frontotemporalno lobularno degeneracijo (FTLD) 1 2 3 4 5. V skupino RNA-vezavnih proteinov spada tudi protein FUS (angl. Fused in sarcoma), katerega toksične agregate najdemo pri ALS in FTLD. Ker zanj velja, da mutacije v genu Fus najdemo le v podskupini primerov ALS, pri FTLD pa jih ni zaslediti, je iz tega moč sklepati, da najbrž mutacije pri FUS ne predstavljajo neposrednega vzroka za razvoj FTLD 6 7 8. To poraja vprašanje, kakšen je torej molekularni mehanizem, ki uravnava napačno lokalizacijo in agregacijo citoplazemskega protein FUS pri FTLD. Prisotnost toksičnih citoplazemskih vključkov proteina FUS v primerih fALS-FUS in FTLD-FUS sicer namiguje na številne mehanizme oziroma njihove kombinacije, ki izhajajo iz izgube funkcije proteina oziroma njegove pridobljene toksičnosti, ki ju povzroča jedrno pomanjkanje proteina FUS oziroma njegova povečana pojavnost v citoplazmi 10 11 12 13. Za popolno razumevanje FUS patofiziologije, pa je nujno razjasniti signalne poti, ki uravnavajo njegovo jedrno-citoplazemsko razporejanje. Spremembe v sintezi in razgradnji proteina FUS, ki vplivajo na njegovo nepravilno kopičenje in agregacijo, poleg mutacij lahko povzročajo tudi post-translacijske modifikacije, ki dokazano vplivajo na fazno ločevanje (angl. Liquid-Liquid Phase Separation, LLPS) in agregabilnost proteina FUS 14 15 16. Znana post-translacijska modifikacija proteina FUS je fosforilacija njegove zadnje aminokisline tirozin (FUSp-Y526). Za slednjo je bilo v preteklosti dokazano, da onemogoča normalno prehajanje proteina FUS v jedro živčnih celic 17. S tem pospeši njegovo nepravilno kopičenje izven jedra v citoplazmi telesa in odrastkov živčnih celic, kjer zaradi povišane koncentracije protein FUS agregira in tvori netopne toksične vključke, ki vodijo v smrt živčne celice 10 11 12.
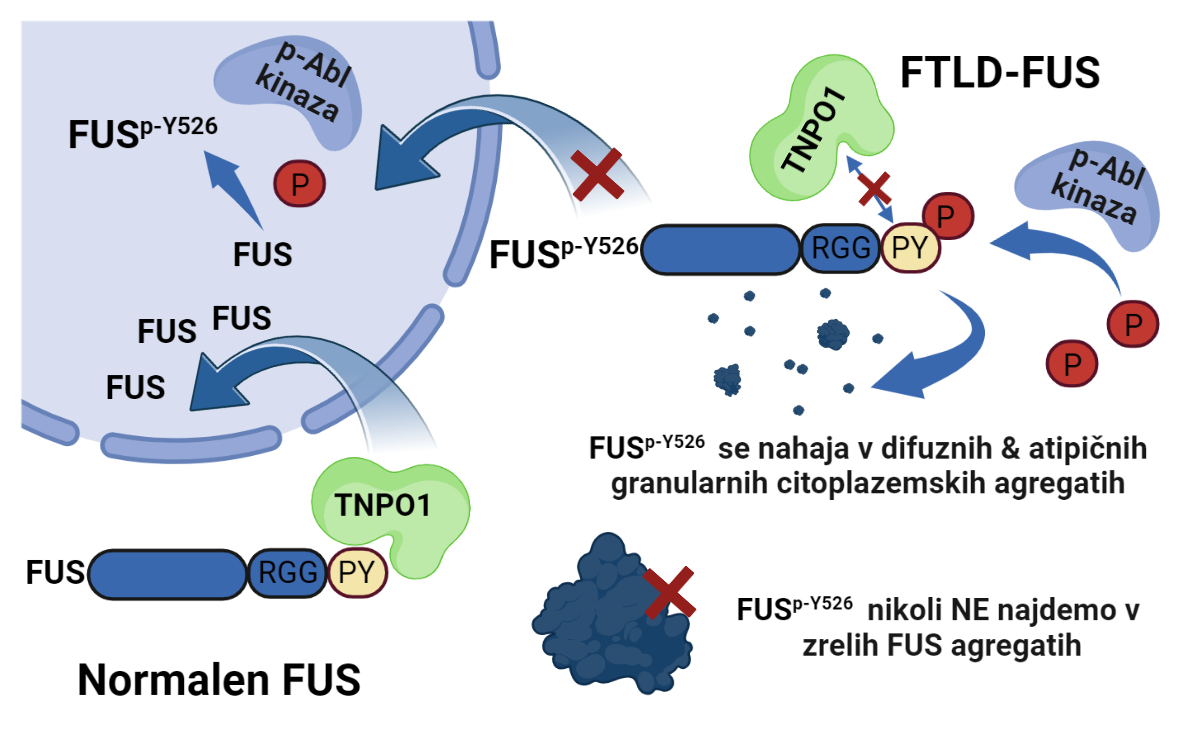
Slika 1: Fosforiliran FUSp-Tyr526 se pri FTLD-FUS obolenju nahaja v povečani meri v jedru nevronov in v atipičnih agregatih v njihovi citoplazmi.
Aktivacija kinaz iz družine Src uravnava fosforilacijo 526Tyr FUS
V raziskavi smo želeli razjasniti mehanizem fosforilacije 526Tyr FUS (FUSp-Y526) in njegov vpliv na jedrno-citoplazemsko razporejanje proteina FUS. V preteklosti smo pokazali, da fosforilacija 526Tyr FUS poveča njegovo citoplazemsko lokalizacijo zaradi inhibirane vezave proteina FUS na jedrni prenašalec TNPO1 17 18 19. Za vpogled v mehanizem fosforilacije Tyr526 FUS smo analizirali vpliv različnih kinaz povezanih s stresom in ALS/FTLD 20 21 22. Sintetizirali in karakterizirani smo specifični detektor (protitelo) za modificirano zadnjo aminokislino (pTyr526) proteina FUS in z napredno mikroskopijo analizirali vzorec razporejanja topnega in netopnega proteina FUSp-Tyr526 v celicah, ki ga komercialno dostopni detektorji ne zaznajo. Dokazali smo, da kar tri kinaze Src, Fyn in Abl fosforilirajo Tyr526 FUS 17. Ker so kinaze Src-družine aktivne tudi v možganih 22, smo raziskali vzorec so-pojavljanja FUSp-Y526 in aktivnih kinaz (pSrc, pFyn, pAbl) v različnih nevronom podobnih diferenciranih celičnih modelih (NSC34, SH-SY5Y), v kultiviranih primarnih kortikalnih nevronih miši in v mišjih možganih, ter ga primerjali z vzorcem pojavljanja FUSp-Y526 in aktivnih kinaz v piramidalnih nevronih čelne skorje možganov bolnikov s FTLD-FUS. Prekrivanje signalov fosforiliranega FUSp-Tyr526 in različnih kinaz je razkrilo odvisnost subcelične lokalizacije FUSp-Y526 od tipa kinaz v celičnih modelih in mišjih možganih. Bistveno spremenjeno jedrno-citoplazemsko razporejanje FUSp-Y526 pa je bilo opaziti v možganih bolnikov s FTLD-FUS v primerjavi z možgani nevrološko normalnih kontrol. Čeprav je bilo v večini kortikalnih nevronov bolnikov s FTLD-FUS opaziti difuzen citoplazemski in srednje do močan jedrni FUSp-Y526 signal, je kar 10–20 % teh kortikalnih nevronov posedovalo tudi majhne atipične zrnate citoplazemske FUSp-Y526 pozitivne vključke. Ti mali zrnati FUSp-Y526 pozitivni agregati, se morfološko razlikujejo od velikih tipičnih globularnih agregatov FUS, ki so zelo redko pozitivni na FUSp-Y526. V skladu s splošnim prepričanjem, da morda zorenje stresnih granul uravnava tvorbo teh večjih agregatov FUS, smo potrdili, da v pogojih oksidativnega stresa kinaza Abl pospeši privzem FUSp-Y526 v G3BP1-pozitivne stresne granule v nevronom podobnih celicah. Čeprav bo šele prihodnja podrobna analiza teh netipičnih zrnatih akumulacij FUSp-Y526 razkrila njihovo natančno vlogo v patologiji FUS-a, pa na podlagi teh rezultatov domnevamo, da so zrnate akumulacije FUSp-Y526 najbrž patološko aktivni predhodniki večjih toksičnih agregatov FUS.
Zaključek
FUSp-Y526 najverjetneje uravnava agregacijo proteina FUS v živčnih celicah pod stresnimi pogoji, ko pride do aktivacije kinaze Abl, ki pospeši privzem modificiranega proteina FUSp-Y526 v netipične agregate oziroma stresne granule, ki prispevajo k zgodnji patologiji FTLD-FUS. Novo razvita protitelesa predstavljajo edinstveno platformo za detekcijo fosforilacije na C-terminalnem 526Tyr FUS, bodisi v jedru ali v citoplazmi; in za analizo interakcij FUSp-Y526 z drugimi oblikami FUS in RBP, ki tvorijo agregate pri FTLD in ostalih FUSopatijah. Aktivacijo kinaze Abl v stresnih pogojih ter njeno vlogo pri spremenjenem razporejanju proteina FUS v nevronih, podajamo kot nov osnovni mehanizem nastanka in napredovanja FUS-FTLD obolenja. Kontrola tega mehanizma bo omogočila preživetje živčnih celic.
-
___
-
Kwiatkowski TJJ, Bosco DA, Leclerc AL, Tamrazian E, Vanderburg CR, Russ C, Davis A, Gilchrist J, Kasarskis E, Munsat T, Valdmanis P, Rouleau GA, Hosler V, Cortelli P, de Jong PJ, Yoshinaga Y, Haines JL, Pericak-Vance MA, Yan J, Ticozzi N, Siddique T, McKenna-Yasek D, Sapp PC, Horvitz HR, Landers JE, Brown RH. Mutations in the FUS/TLS gene on chromosome 16 cause familial amyotrophic lateral sclerosis. Science. 2009;323(5918):1205-1208. doi:10.1126/science.1166066 ↩
-
Vance C, Rogelj B, Hortobágyi T, De Vos KJ, Nishimura AL, Sreedharan J, Hu X, Smith B, Ruddy D, Wright P, Ganesalingam J, Williams KL, Tripathi V, Al-Saraj S, Al-Chalabi A, Leigh PN, Blair IP, Nicholson G, de Belleroche J, Gallo JM, Miller CC, Shaw CE. Mutations in FUS, an RNA processing protein, cause familial amyotrophic lateral sclerosis type 6. Science. 2009;323(5918):1208-1211. doi:10.1126/science.1165942 ↩
-
Cairns NJ, Ghoshal N. FUS: A new actor on the frontotemporal lobar degeneration stage. Neurology. 2010;74(5):354-356. doi:10.1212/WNL.0b013e3181ce5dd6 ↩
-
Prpar Mihevc S, Darovic S, Kovanda A, Bajc Česnik A, Župunski V, Rogelj B. Nuclear trafficking in amyotrophic lateral sclerosis and frontotemporal lobar degeneration. Brain. 2017;140(1):13-26. doi:10.1093/brain/aww197 ↩
-
Rogelj B, Easton LE, Bogu GK, Stanton LW, Rot G, Curk T, Zupan B, Sugimoto Y, Modic M, Haberman N, Tollervey J, Fujii R, Takumi T, Shaw CE, Ule J. Widespread binding of FUS along nascent RNA regulates alternative splicing in the brain. Sci Rep. 2012;2:603. doi:10.1038/srep00603 ↩
-
Snowden JS, Hu Q, Rollinson S, Halliwell N, Robinson A, Davidson YS, Momeni P, Baborie A, Griffiths TD, Jaros E, Perry RH, Richardson A, Pickering-Brown SM, Neary D, Mann DMA. The most common type of FTLD-FUS (aFTLD-U) is associated with a distinct clinical form of frontotemporal dementia but is not related to mutations in the FUS gene. Acta Neuropathol. 2011;122(1):99-110. doi:10.1007/s00401-011-0816-0 ↩
-
Rhine K, Makurath MA, Liu J, Skanchy S, Lopez C, Catalan KF, Ma Y, Fare CM, Shorter J, Ha T, Chemla YR, Myong S. ALS/FTLD-Linked Mutations in FUS Glycine Residues Cause Accelerated Gelation and Reduced Interactions with Wild-Type FUS. Mol Cell. 2020;80(4):666-681.e8. doi:10.1016/j.molcel.2020.10.014 ↩
-
Naumann M, Laubenthal J, Hermann A. Fused in sarcoma-amyotrophic lateral sclerosis as a novel member of DNA single strand break diseases with pure neurological phenotypes. Neural Regen Res. 2021;16(1):110-112. doi:10.4103/1673-5374.286963 ↩
-
Lysikova EA, Kukharsky MS, Chaprov KD, Vasilieva NA, Roman AY, Ovchinnikov RK, Deykin AV, Ninkina N, Buchman VL. Behavioural impairments in mice of a novel FUS transgenic line recapitulate features of frontotemporal lobar degeneration. Genes Brain Behav. 2019;18(8):e12607. doi:10.1111/gbb.12607 ↩
-
Lysikova EA, Funikov S, Rezvykh AP, Chaprov KD, Kukharsky MS, Ustyugov A, Deykin AV, Flyamer IM, Boyle S, Bachurin SO, Ninkina N, Buchman VL. Low Level of Expression of C-Terminally Truncated Human FUS Causes Extensive Changes in the Spinal Cord Transcriptome of Asymptomatic Transgenic Mice. Neurochem Res. 2020;45(5):1168-1179. doi:10.1007/s11064-020-02999-z ↩
-
Shelkovnikova TA, Peters OM, Deykin AV, Connor-Robsob N, Robson H, Ustyugov AA, Bachurin SO, Ermolkevich TG, Goldman IL, Sadchikova ER, Kovrazhkina EA, Skvortsova VI, Ling SC, Da Cruz S, Parone PA, Buchman VL, Ninkina NN. Fused in sarcoma (FUS) protein lacking nuclear localization signal (NLS) and major RNA binding motifs triggers proteinopathy and severe motor phenotype in transgenic mice. J Biol Chem. 2013;288(35):25266-25274. doi:10.1074/jbc.M113.492017 ↩
-
Mitchell JC, McGoldrick P, Vance C, Hortobagyi T, Sreedharan J, Rogelj B, Tudor EL, Smith BN, Klasen C, Miller CCJ, Cooper JD, Greensmith L, Shaw CE. Overexpression of human wild-type FUS causes progressive motor neuron degeneration in an age- and dose-dependent fashion. Acta Neuropathol. 2013;125(2):273-288. doi:10.1007/s00401-012-1043-z ↩
-
Kang J, Lim L, Song J. ATP enhances at low concentrations but dissolves at high concentrations liquid-liquid phase separation (LLPS) of ALS/FTD-causing FUS. Biochem Biophys Res Commun. 2018;504(2):545-551. doi:10.1016/j.bbrc.2018.09.014 ↩
-
Shorter J. Liquidizing FUS via prion-like domain phosphorylation. EMBO J. 2017;36(20):2925-2927. doi:10.15252/embj.201798078 ↩
-
Ikenaka K, Ishigaki S, Iguchi Y, Kawai K, Fujioka Y, Yokoi S, Abdelhamid RF, Nagano S, Mochizuki H, Katsuno M, Sobue G. Characteristic Features of FUS Inclusions in Spinal Motor Neurons of Sporadic Amyotrophic Lateral Sclerosis. J Neuropathol Exp Neurol. 2020;79(4):370-377. doi:10.1093/jnen/nlaa003 ↩
-
Darovic S, Prpar Mihevc S, Župunski V, Gunčar G, Štalekar M, Lee YB, Shaw CE, Rogelj B. Phosphorylation of C-terminal tyrosine residue 526 in FUS impairs its nuclear import. J Cell Sci. 2015;128(22):4151-4159. doi:10.1242/jcs.176602 ↩
-
Yoshizawa T, Ali E, Jiou J, Fung HYJ, Burke KA, Kim SJ, Lin Y, Peeples WB, Saltzberg D, Soniat M, Baumhardt JM, Oldenbourg R, Sali A, Fawzi NL, Rosen MK, Chook YM. Nuclear Import Receptor Inhibits Phase Separation of FUS through Binding to Multiple Sites. Cell. 2018;173(3):693-705.e22. doi:10.1016/j.cell.2018.03.003 ↩
-
Guo L, Kim HJ, Wang H, Monaghan J, Freyermuth F, Sung JC, O’Donovan K, Fare CM, Diaz Z, Singh N, Zhang ZC, Coughlin M, Sweeny EA, DeSantis ME, Jackrel ME, Rodell CB, Burdick JA, King OD, Gitler AD, Lagier-Tourenne C, Pandey UB, Chook YM, Taylor JP, Shorter J. Nuclear-Import Receptors Reverse Aberrant Phase Transitions of RNA-Binding Proteins with Prion-like Domains. Cell. 2018;173(3):677-692.e20. doi:10.1016/j.cell.2018.03.002 ↩
-
Palomo V, Nozal V, Rojas-Prats E, Gil C, Martinez A. Protein kinase inhibitors for amyotrophic lateral sclerosis therapy. Br J Pharmacol. 2021;178(6):1316-1335. doi:10.1111/bph.15221 ↩
-
Ko HS, Lee Y, Shin JH, Karuppagounder SS, Gadad BS, Koleske AJ, Pletnikova O, Troncoso JC, Dawson VL, Dawson TM. Phosphorylation by the c-Abl protein tyrosine kinase inhibits parkin’s ubiquitination and protective function. Proc Natl Acad Sci U S A. 2010;107(38):16691-16696. doi:10.1073/pnas.1006083107 ↩
-
Owen I, Rhoads S, Yee D, Wyne H, Gery K, Hannula I, Sendrum M, Shewmaker F. The prion-like domain of Fused in Sarcoma is phosphorylated by multiple kinases affecting liquid- and solid-phase transitions. Mol Biol Cell. 2020;31(23):2522-2536. doi:10.1091/mbc.E20-05-0290 ↩