Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Zunajcelični vezikli kot prenašalci zdravilnih učinkovin preko krvno-možganske prepreke
članki
eSinapsa, 2011-1
Zvezdan Pirtošek
Eksoskeleti – inteligentne bionske naprave
Marko Munih
O aktualnih dilemah draženja globokih možganskih struktur pri obsesivno - kompulzivni motnji
Nadja Jarc
Sledite svojo srečo ... z iPhone
Urban Kordeš
eSinapsa, 2011-2
Renata Salecl
Gašper Tkačik
Astrociti – spregledane zvezde nevrobiologije
Marko Kreft, Robert Zorec
Sašo Dolenc
Meditacija - malo truda, veliko koristi
Luka Dimic
eSinapsa, 2011-3
Mara Bresjanac
Martina Starc
Rok Berlot
Varnost uporabe generičnih protiepileptičnih zdravil
Mojca Kržan, Matevž Kržan
Možgani, računalniki - nekaj vmes
Miha Pelko
eSinapsa, 2012-4
Ali so moški in ženski možgani različni?
Gregor Majdič
O kognitivnih motnjah pri bolnikih s Parkinsonovo boleznijo
Dejan Georgiev
Akutno možgansko kap lahko uspešno zdravimo
Nina Vujasinovič, Bojana Žvan
Vloga nevropsihološke diagnostike pri odkrivanju zgodnjih znakov alzheimerjeve bolezni
Simon Brezovar
eSinapsa, 2013-5
Subarahnoidna krvavitev zaradi tromboze venskih sinusov
Mateja Repar, Anita Resman Gašperčič
Srečanje dveh velikanov: možganov in imunskega sistema
Matej Markota
Novo odkritje na področju sporadičnih prionskih bolezni
Jana Jerše, Nadja Jarc
Učinek placeba brez lažnih zdravil in zavajanja
Mara Bresjanac
eSinapsa, 2013-6
Odstranjevanje možganskih tumorjev pri budnem bolniku
Andrej Vranič, Jasmina Markovič, Blaž Koritnik
Zmedena bolnica, ki nič ne vidi ali PRES
Manja Hribar, Vid Zgonc
Manja Hribar
Sistemska skleroza in ishemična možganska kap - vzročna povezanost ali le koincidenca?
Mateja Repar, Janja Pretnar Oblak
Netravmatska lokalizirana konveksitetna subarahnoidna krvavitev
Mateja Repar, Fajko F. Bajrović
Klemen Grabljevec
Z omejevanjem spodbujajoča terapija pri bolnikih po nezgodni možganski poškodbi
Dejana Zajc, Klemen Grabljevec
eSinapsa, 2014-7
Možgani v mreži navezanosti, ki nas zaznamuje
Barbara Horvat
Vpliv senzoričnega dotoka na uglasitev možganskih povezav
Peter Gradišnik
Človeški konektom ali kakšne so zveze v naših možganih
Blaž Koritnik
Niko Lah
Torkove delavnice za osnovnošolce
Mateja Drolec Novak, Vid V. Vodušek
Da ne pozabim! Tehnike za pomladitev spomina
Klara Tostovršnik, Hana Hawlina
Površina socialne nevroznanosti
Manuel Kuran
Clarity - bistri možgani Karla Deisserotha
Gregor Belušič
Barbara Gnidovec Stražišar
Bojana Žvan
Nevroplastičnost po možganski kapi
Marjan Zaletel
Klinično psihološka obravnava pacientov po možganski kapi in podpora pri vračanju na delovno mesto
Barbara Starovasnik Žagavec
Možgani: organ, s katerim ljubimo
Andraž Matkovič
Marija Šoštarič Podlesnik
Gibalno-kognitivna vadba: praktična delavnica
Mitja Gerževič, Marina Dobnik
Anton Grad
Nevrologija, imunologija, psihiatrija …
Bojan Rojc
Andraž Stožer, Janez Bregant
Dominika Novak Pihler
Možganska kap – »kako ostati v omrežju?«
Nina Ozimic
Klara Tostovršnik
eSinapsa, 2014-8
Znotrajžilno zdravljenje možganskih anevrizem
Tamara Gorjanc, Dimitrij Lovrič
Obravnava hladnih možganskih anevrizem
Bojana Žvan, Janja Pretnar Oblak
Ali deklice z Rettovim sindromom govorijo z očmi?
Anka Slana, Urška Slana
Progresivna multifokalna encefalopatija
Urša Zabret, Katarina Šurlan Popovič
Ne ubijaj – poskusi na živalih
Martina Perše
Poizkusi na živalih - za in proti
Simon Horvat
eSinapsa, 2015-9
Kako deluje navigacijski sistem v naših možganih
Simon Brezovar
Vsakodnevno delo slepe osebe / s slepo osebo
Denis Kamnar
Uroš Marušič
Manca Tekavčič Pompe
Toni Pustovrh
Marko Hawlina
Od svetlobe do podobe ali kako vidijo svet naši možgani
Simon Brezovar
Janja Hrastovšek
Zala Kurinčič
Pogledi na mejno osebnostno motnjo
Jerica Radež, Peter Kapš
Uvid kot socialno psihološki fenomen
Vid Vodušek
Uvod v vidno-prostorske funkcije s praktičnimi primeri
Ana Bujišić, Sanja Roškar
eSinapsa, 2015-10
Difuzijsko magnetnoresonančno slikanje
Rok Berlot
Katja Pavšič
Radiološko izolirani sindrom - ali ga moramo poznati?
Matej Vouk, Katarina Šurlan Popovič
Kako izgledajo možgani, ki govorijo več jezikov?
Gašper Zupan
Nov pristop v rehabilitaciji - terapija s pomočjo psa
Mateja Drljepan
Pogled v maternico z magnetnoresonančno preiskavo
Taja Jordan, Tina Vipotnik Vesnaver
Saša Zorjan
Saša Zorjan
Nevroestetika: ko nevroznanost obišče galerijo
Anja Voljavec, Hana Hawlina, Nika Vrabič
Ali so psihogeni neepileptični napadi res psihogeni?
Saška Vipotnik, Gal Granda
Kako nam lahko glasna glasba »vzame« sluh in povzroči tinitus
Nejc Steiner, Saba Battelino
eSinapsa, 2016-11
Mara Bresjanac
Kako ultrazvok odpira pot v možgane
Kaja Kolmančič
Kako je epigenetika spremenila nevroznanost
Metka Ravnik Glavač
Ondinino prekletstvo ali sindrom prirojene centralne hipoventilacije
Katja Pavšič, Barbara Gnidovec Stražišar, Janja Pretnar Oblak, Fajko F. Bajrović
Motnje ravnotežja otrok in odraslih
Nejc Steiner, Saba Battelino
Zika virus in magnetnoresonančna diagnostika nepravilnosti osrednjega živčevja pri plodu
Rok Banko, Tina Vipotnik Vesnaver
eSinapsa, 2016-12
Vloga magnetnoresonančne spektroskopije pri obravnavi možganskih tumorjev
Gašper Zupan, Katarina Šurlan Popovič
Tiskanje tridimenzionalnih modelov v medicini
Andrej Vovk
Aleš Oblak
Kevin Klarič
Sinestezija: umetnica, ki ne želi odrasti
Tisa Frelih
Računska psihiatrija: od nevroznanosti do klinike
Nastja Tomat
Kognitivni nadzor: od vsakdanjega življenja do bolezni
Vida Ana Politakis
eSinapsa, 2017-13
Internet: nadgradnja ali nadomestek uma?
Matej Perovnik
Vloga črevesnega mikrobioma pri odzivu na stres
Vesna van Midden
Stres pušča posledice tako na človeškem kot živalskem organizmu
Jasmina Kerčmar
Prikaz normalne anatomije in bolezenskih stanj obraznega živca z magnetno resonanco
Rok Banko, Matej Vrabec
Psihedelična izkušnja in njen zdravilni potencial
Anja Cehnar, Jona Basle
Vpliv hiperglikemije na delovanje možganov
Jasna Šuput Omladič, Simona Klemenčič
Nevrofibromatoza: napredujoče obolenje centralnega in perifernega živčevja
Nejc Steiner, Saba Battelino
Fenomen žrtvenega jagnja v dobi interneta
Dolores Trol
Tesnoba staršev in strategije spoprijemanja, ko pri otroku na novo odkrijejo epilepsijo
Daša Kocjančič, Petra Lešnik Musek, Vesna Krkoč, David Gosar
eSinapsa, 2017-14
Zakaj ne zapeljem s ceste, ko kihnem?
Anka Slana Ozimič, Grega Repovš
Nobelova nagrada za odkritje molekularnih mehanizmov nadzora cirkadianih ritmov
Leja Dolenc Grošelj
Možgani pod stresom: od celic do duševnih motenj
Nastja Tomat
Na sledi prvi vzročni terapiji Huntingtonove bolezni
Danaja Metul
Razlike med spoloma pri Parkinsonovi bolezni
Kaja Kolmančič
eSinapsa, 2018-15
Susceptibilno poudarjeno magnetnoresonančno slikanje pri bolniku z ALS
Alja Vičič, Jernej Avsenik, Rok Berlot
Sara Fabjan
Reverzibilni cerebralni vazokonstrikcijski sindrom – pot do diagnoze
Maja Cimperšek, Katarina Šurlan Popovič
Liam Korošec Hudnik
Kognitivno funkcioniranje pri izgorelosti
Marina Horvat
eSinapsa, 2019-16
Maša Čater
Saša Koprivec
Infekcije osrednjega živčnega sistema s flavivirusi
Maja Potokar
Raziskava: Kako depresija vpliva na kognitivne sposobnosti?
Vida Ana Politakis
Razvoj depresije pri otrocih z vidika navezovalnega vedenja
Neža Grgurevič
Sonja Prpar Mihevc
Umetno inteligentna nevroznanost: srečanje nevronskih mrež in možganske fiziologije
Kristijan Armeni
Čebelji strup pri preventivi nevrodegenerativnih bolezni in priložnost za klinično prakso
Matjaž Deželak
eSinapsa, 2019-17
IgG4+ – skupni imenovalec diagnoz iz preteklosti
Cene Jerele, Katarina Šurlan Popovič
Nov molekulski mehanizem delovanja ketamina v astrocitih
Matjaž Stenovec
Praktični pristop k obravnavi utrujenosti in motenj spanja pri bolnikih z multiplo sklerozo
Nik Krajnc, Leja Dolenc Grošelj
Jure Pešak
eSinapsa, 2020-18
Bolezni spektra anti-MOG pri odraslih
Nik Krajnc
Samomor pod lupo nevroznanosti
Alina Holnthaner
eSinapsa, 2020-19
Ob mednarodnem dnevu znakovnih jezikov
Anka Slana Ozimič
Teorija obetov: kako sprejemamo tvegane odločitve
Nastja Tomat
Sara Fabjan
Matjaž Deželak
Nina Stanojević, Uroš Kovačič
Od človeških nevronov do možganskih organoidov – nova obzorja v nevroznanosti
Vesna M. van Midden
Splošna umetna inteligenca ali statistične jezikovne papige?
Kristijan Armeni
Zunajcelični vezikli kot prenašalci zdravilnih učinkovin preko krvno-možganske prepreke
Saša Koprivec
Matjaž Deželak
eSinapsa, 2021-20
Migrena: starodavna bolezen, sodobni pristopi k zdravljenju
Eva Koban, Lina Savšek
Zgodnji razvoj socialnega vedenja
Vesna Jug
Nastja Tomat
Mikrosplet: povezovanje preko mikrobioma
Tina Tinkara Peternelj
Stimulacija možganov kot način zdravljenja depresije
Saša Kocijančič Azzaoui
eSinapsa, 2021-21
eSinapsa, 2022-22
Sodobni vidiki motenj hranjenja
Karin Sernec
Ples in gibalni dialog z malčki
Neva Kralj
Atul Gawande
Jezikovna funkcija pri Alzheimerjevi bolezni
Gašper Tonin
Dostava terapevtikov preko krvno-možganske pregrade
Matjaž Deželak
eSinapsa, 2022-23
Akutni ishemični infarkt hrbtenjače pri zdravih otrocih – kaj lahko pove radiolog?
Katarina Šurlan Popovič, Barbara Šijaković
eSinapsa, 2023-24
Možganska omrežja pri nevrodegenerativnih boleznih
Tomaž Rus, Matej Perovnik
Morske živali kot navdih za nevroznanstvenike: morski konjiček, morski zajček in klobučnjak
Tina Bregant
Metoda Feldenkrais: gibanje in nevroplastičnost
Mateja Pate
Etično naravnana animalna nevroznanost
Maša Čater
Helena Motaln, Boris Rogelj
eSinapsa, 2023-25
Urban Košak, Damijan Knez, Anže Meden, Simon Žakelj, Jurij Trontelj, Jure Stojan, Maja Zakošek Pipan, Kinga Sałat idr.
eSinapsa, 2024-26
Naravno okolje kot vir zdravja in blagostanja
Karin Križman, Grega Repovš, Gaja Zager Kocjan, Gregor Geršak
Katja Peganc Nunčič, Damjan Osredkar
Tanja Goltnik
Ali je zgodnje vstajanje dedno?
Cene Skubic, Laura Plavc, Damjana Rozman, Leja Dolenc Grošelj
eSinapsa, 2024-27
Širša terapevtska uporaba ketamina: potenciali in izzivi
Kristian Elersič
Moč vpliva socialne opore na bolečino
Jana Verdnik
Benjamin Bušelič
Urška Černe, Anemari Horvat, Robert Zorec, Nina Vardjan
eSinapsa, 2025-28
Maša Čater, Nastja Blagovič, Urška Jerič, Agata Kokalj Malovrh, Nuša Balen, Tanja Kunej
Vpliv izobrazbe na skrb za zdravje možganov
Hana Kos, Matej Perovnik
Selena Horvat, Anja Pišlar
Kljub hitremu napredku znanosti številne bolezni centralnega živčnega sistema ostajajo uganka. V primerjavi s pojavom novih metod zdravljenja število bolnikov z nevrodegenerativnimi obolenji in možganskim rakom v zadnjih letih raste eksponentno. Pomemben faktor predstavlja krvno-možganska prepreka, ki možgane ščiti pred negativnimi vplivi, hkrati pa onemogoča vnos zdravil in zmanjšuje učinkovitost obstoječih terapij. Znanost je vedno usmerjena v iskanje novih tehnologij, ki bi omogočile ustrezno zdravljenje s čim manj stranskimi učinki, in tako je tudi pri iskanju novih možnosti prenosa zdravilnih učinkovin preko krvno-možganske prepreke.
Število bolnikov z boleznimi centralnega živčnega sistema (CŽS) zaradi staranja prebivalstva narašča, razvoj novih zdravil in terapij pa temu trendu rasti ne sledi 1. Nevrodegenerativna obolenja (med drugimi so bolj splošno prepoznavne Alzheimerjeva, Parkinsonova in Huntingtonova bolezen) imajo velik vpliv na zmanjšanje kvalitete življenja, bolniki predstavljajo tudi finančno in socialno breme 2. Po podatkih Svetovne zdravstvene organizacije (angl. World Health Organization) so bile nevrodegenerativne bolezni v letu 2016 peti najpogostejši vzrok smrti 3. Velik del raziskav je usmerjen v iskanje učinkovitih pristopov za zdravljenje bolezni CŽS. Velik korak naprej predstavljajo novejše raziskave uporabe zunajceličnih veziklov. Vezikli, ki prihajajo iz CŽS, nam posredujejo informacije o samih živčnih celicah. Vezikli, ki jih pošljemo nazaj v CŽS, pa omogočajo ciljni vnos učinkovin do celic živčnega sistema 4. Ko bomo razvili ustrezne podporne tehnologije, bo sposobnost zunajceličnih veziklov za prenos zdravil preko bioloških preprek revolucionarno vplivala na zdravljenje nevroloških bolezni 2.
Vloga krvno-možganske prepreke
Krvno-možganska prepreka (KMP) deluje kot zapornica, ki zaradi tesnih medceličnih stikov onemogoča prosti pretok snovi med možgani in perifernim krvnim obtokom in tako sodeluje pri vzdrževanju homeostaze CŽS 5 6. Sestavljena je iz tesnega prepleta kapilar, ki jih gradijo endotelijske celice skupaj s periciti, astrociti, tesnimi stiki, nevroni in bazalno membrano (slika 1) 1. Zaradi zmanjšane prepustnosti so možgani zaščiteni pred toksičnimi snovmi, ki so lahko prisotne in krožijo po krvnem obtoku, s terapevtskega vidika pa ta lastnost zelo otežuje vnos zdravil 2.
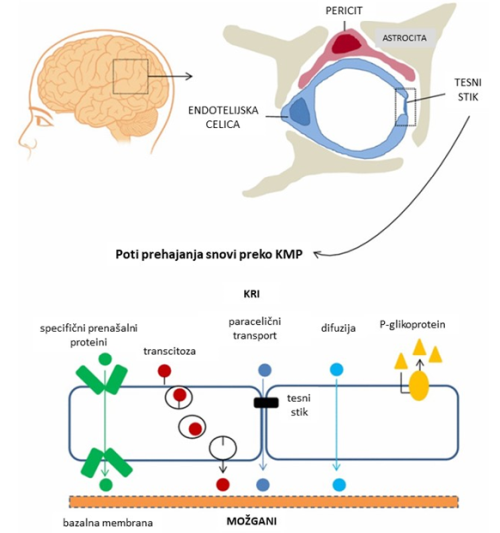
Slika 1. Poti prehajanja molekul preko krvno-možgansko prepreko (KMP). KMP sestavljajo tesne možganske kapilare, ki jih tvorijo endotelijske celice, pericite, astrociti, tesni stiki med temi celicami, nevroni in bazalna membrana. Ioni in drugi topljenci, ki so dovolj majhni, se lahko poslužujejo koncentracijskega gradienta ter preko KMP prehajajo s pasivno difuzijo skozi ozek medcelični prostor med dvema celicama (tj. paracelični prenos snovi). Transcelični transport vključuje različne mehanizme prehajanja snovi, npr. pasivno difuzijo preko celice, delovanje celičnih prenašalcev ali transcitoza. Na prepustnost KMP vpliva še delovanje različnih aktivnih prenašalcev, kot je P-glikoprotein, ki omogočajo prenos lipofilnih snovi (prirejeno po 2).
KMP je dinamična struktura, ki se nenehno prilagaja fiziološkim spremembam v možganih (mikrookolje) in signalom, ki izhajajo iz zunanjega okolja 5. Molekule lahko prečkajo KMP na dva načina. KMP lahko prosto prehajajo le molekule, ki so topne v lipidih in manjše od 400 Da. Takšne majhne molekule (npr. ioni) lahko izkoristijo paracelične transportne poti in prehajajo v CŽS skozi špranje med sosednjimi celicami. Druga možnost transporta je prehajanje preko celic, kjer se molekule poslužujejo različnih načinov prenosa – difuzije, prenosa preko transportnih proteinov ali transcitoze. Fizikalno-kemijske lastnosti molekule določajo ali in na kakšen način bo ta prestopila mejo KMP. Patološka bolezenska stanja CŽS, kot so možganska kap, sladkorna bolezen, hipertenzijska encefalopatija, AIDS, multipla skleroza ter Parkinsonova in Alzheimerjeva bolezen, povzročijo moteno prepustnost KMP 1.
Pristopi za vnos zdravil v CŽS
Preizkušajo se številne metode vnosa zdravil preko KMP. Virusni vektorji posedujejo naravno sposobnost vnosa nukleinskih kislin v celice. Raziskovalci se že več desetletij ukvarjajo z vnosom v virusne vektorje vključenih genov preko KMP za zdravljenje bolnikov z nevrološkimi obolenji. Vendar je proizvodnja težavna in draga, terapija z virusi pa vzbuja varnostne pomisleke, tudi zaradi številnih smrti bolnikov v kliničnih testiranjih 7. Nanodelci omogočajo ciljano dostavo zdravil do možganov, vendar sami po sebi niso vedno sposobni prečkati KMP, temveč delujejo tako, da zdravilu omogočijo daljši čas zadrževanja na ciljnem mestu 8. Tudi liposomi predstavljajo vsestranski in fleksibilen sistem, ki ima številne prednosti (ustrezna zaščita zdravila, ki ga prenašamo, obstojnost v krvnem sistemu, biorazgradljivost, nizka toksičnost). Ker niso endogenega izvora, obstaja verjetnost sprožitve imunskega sistema preko aktivacije sistema komplementa ali fagocitoze s strani makrofagov 9. Še en pristop uporablja obstoječe transportne sisteme – vezavo zdravil na ciljne aminokisline, ki lahko aktivno prečkajo KMP – vendar je tak pristop uporaben samo za majhne molekule. Z določenimi neinvazivnimi tehnikami (ultrazvok) lahko olajšamo prehod zdravil preko KMP, obstaja pa nevarnost toksičnosti za zdravo možgansko tkivo 4. V zadnjih letih se intenzivno raziskuje možnost uporabe zunajceličnih veziklov, natančneje eksosomov, za ciljni vnos zdravil preko KMP.
Kaj so zunajcelični vezikli?
Termin zunajcelični vezikli zajema heterogeno skupino veziklov, ki jih izločajo celice (so telesu avtologni) in prenašajo raznovrsten celični tovor bodisi v bližnje mikrookolje bodisi do oddaljenih mest s pomočjo obtočilnega sistema 6. Ločimo eksosome, mikrovezikle in apoptotska telesca (slika 2). Glede na izvor (progenitorska celica) se vezikli med seboj razlikujejo, saj vsebujejo specifične citosolne proteine, lipide in genetski material (mRNA, miRNA, druge majhne nekodirajoče RNA, gDNA izvorne celice). Na njihovo vsebino vplivajo tudi zunanji dejavniki, katerim je celica izpostavljena v času nastanka vezikla, zato se le-ti razlikujejo tudi, če izvirajo iz iste skupine celic (npr. izpostavljenost toksičnim snovem, hipoksični pogoji ipd.) 10. Eksosomi so podskupina zunajceličnih veziklov, ki se od drugih najbolj razlikujejo po svoji velikosti. Merijo nekje od 30 do 100 nm, kar pomeni, da sodijo v velikostni razred nanodelcev 12. Pod elektronskim mikroskopom je vidna značilna morfologija sploščene krogle, ki je omejena z lipidnim dvoslojem 11. O njihovi vlogi v telesu še ne vemo vsega, jasno pa je, da imajo pomembno vlogo v medcelični komunikaciji, tako v normalni pogojih kot v določenih patoloških stanjih 9.
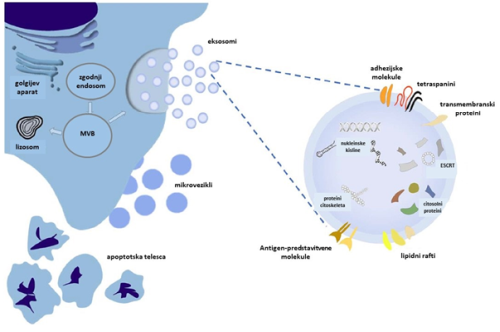
Slika 2. Grafična ponazoritev biogeneze in sestave zunajceličnih veziklov. Termin zunajcelični vezikli zajema različne vrste veziklov – eksosome (30–150 nm), mikrovezikle (50nm–1 µm) in apoptotska telesca (do 5 µm). Eksosomi, ki so najbolje preučeni, nastanejo z notranjim brstenjem t. i. multivezikularnih telesc (MVB, angl. MultiVesicular Bodies). MVB se ob stiku z lizosomom razgradijo ali pa ob zlitju s plazemsko membrano v zunajcelični prostor sproščajo eksosome. Mikrovezikli so večji kot eksosomi in nastanejo z brstenjem celične membrane. Največja so apoptotska telesca, nastajajo pa kot odpadni/izvrženi material celic, ki vstopajo v cikel programirane celične smrti ali apoptoze. Eksosomi so bogati z lipidnimi rafti (flotilin-1, holesterol), nukleinskimi kislinami (DNA in RNA) in številnimi proteini (adhezijske molekule, tetraspanini, citosolni proteini, komponente endosomalnih kompleksov, potrebnih za transport-ESCRT) (prirejeno po 11).
Zaradi unikatnih lastnosti se raziskujejo možnosti uporabe eksosomov kot bioloških označevalcev za zgodnjo in neinvazivno diagnostiko ali prognozo bolezni CŽS 12. Ker izvirajo iz celic, se lahko izognejo imunskemu sistemu in fagocitozi. Ciljne celice jih privzamejo, zato so sposobni svoj tovor dostaviti direktno v citoplazmo, s čimer se znotraj receptorske celice izognejo delovanju lizosomov ali drugih poti razgradnje 9.
Raziskave nakazujejo, da imajo pri boleznih CŽS eksosomi dvojno vlogo. Po eni strani celice eksosome uporabljajo, da iz citoplazme izločajo toksične proteine in agregate, po drugi strani pa lahko eksosomi interagirajo z zdravimi celicami, prenašajo svoj toksični tovor in širijo patološke spremembe 10. Rajendran in sodelavci so na primer pokazali, da eksosomi, ki izvirajo iz nevronov, pospešujejo združevanje in/ali razpad beljakovin Aβ in proteinov tau, ki so odgovorni za nastanek amiloidnih plakov, značilnih za napredovanje Alzheimerjeve bolezni 13.
Zunajcelični vezikli omogočajo prenos tovora preko KMP
Idealni scenarij za vnos zdravil do tarče je, da zdravilo spravimo na mesto učinkovanja, tam v bioaktivni koncentraciji deluje na obolele celice (»jih ozdravi«) lokalno, pri tem pa sočasno ne povzroča škode ali sistemskih stranskih učinkov. Vektorji prenosa morajo biti navadno konjugirani z biološko prepoznavno enoto, ki se lahko veže na površino ciljne celice. Težava je v tem, da se ciljni receptorji konjugiranega liganda navadno ne nahajajo zgolj na tarči, temveč tudi na zdravem tkivu. Eksosomi, ki se izločajo iz različnih celic, pa so selektivno usmerjeni in jih torej predhodno ni potrebno manipulirati, da bi dosegli specifičnost njihovega delovanja. Predstavljajo idealne vektorje za prenos bioloških molekul do tarče, saj so telesu lastni, niso citotoksični, so ciljno specifični in lahko prehajajo preko bioloških preprek ter tako omogočajo personaliziran pristop k zdravljenju 11.
Številne študije nakazujejo, da lahko zunajcelični vezikli iz perifernih endotelijskih celic prečkajo KMP in prenesejo vsebino v CŽS. Iz tega izhaja ideja, da bi jih uporabili kot prenašalce za prenos bioloških molekul ali zdravil preko KMP. Alvarez-Erviti in sodelavci so z uporabo avtolognih eksosomov dendritičnih celic pri miših za vnos molekule siRNA BACE1 (beta-sekretaza 1, encim, ki sodeluje pri tvorbi mielinskih ovojnic in je povezan z nastankom Alzheimerjeve bolezni pri mišjem modelu) dosegli znižanje regulacije proteina BACE1. S poskusom so potrdili, da lahko eksosome uporabimo kot varno in učinkovito orodje za neinvaziven vnos molekul preko KMP, hkrati pa ne sprožimo imunskega odziva 14. V drugi študiji so Zhuang in sodelavci v eksosome vključili molekule inhibitorja, ki je upočasnil rast tumorja, za vnos pa uporabili intranazalno pot injiciranja 15. Pri mišjem modelu Parkinsonove bolezni so Cooper in sodelavci v eksosome z vezanim peptidom RVG (angl. Rabbies Virus Glycoprotein), ki se ciljno veže na nevralne celice in endotelijske celice v možganih in pozitivno vpliva na prehajanje KMP, vključili molekule siRNA za regulacijo gena za α-sinukelin. Agregati α-sinukelina so glavne sestavine Lewijevih telesc, poglavitne patološke možganske spremembe Parkinsonove bolezni. Z vnosom molekule siRNA so raziskovalci zmanjšali vsebnost celokupnega in agregiranega α-sinukelina v mišjih možganih in pokazali, da je pod določenimi pogoji mogoče upočasniti patološke spremembe 16.
Eksosomi kot terapevtsko orodje za zdravljenje bolezni CŽS
Ker eksosomi lahko prehajajo KMP, se preučujejo številni pristopi za zdravljenje bolezni CŽS z eksosomi kot terapevtskimi vektorji. Naštetih je nekaj najpogosteje uporabljenih pristopov:
Terapevtske aplikacije z uporabo nespremenjenih eksosomov. Eksosomi sami po sebi vsebujejo zelo raznolik tovor (odvisno, od kje izvirajo) in imajo v primerjavi s progenitorsko celico prehoden učinek na ciljne celice, kar jih naredi bolj varne. Terapevtsko delovanje multipotentnih mezenhimskih matičnih celic je na primer odvisno od njihovega sekretoma, ta pa poleg eksosomov vsebuje še druge molekule, ki lahko negativno vplivajo na ciljno tkivo.
Vnos terapevtskih učinkovin v nespremenjene eksosome. Gre za poseben pristop, saj je potrebno učinkovino vnesti v eksosome tekom same biogeneze. Biomolekule ali zdravilne učinkovine mora najprej ponotranjiti progenitorska celica, to pa dosežemo tako, da jih inkubiramo skupaj pod definiranimi pogoji. Izločeni eksosomi vsebujejo želeno molekulo, trenutno največji izziv pa je doseči dovolj veliko količino izločenih eksosomov z vsebovano učinkovino. Drug način je, da učinkovino vnesemo v že izolirane eksosome – s pasivno inkubacijo ali aktivnimi načini vnosa (elektroporacija, tretiranje z detergenti ali ultrazvokom).
Eksosomi in vnos farmacevtskih učinkovin. Ta način je za raziskovalce posebno zanimiv v povezavi s prehajanjem KMP. Gre za pasiven vnos zdravil in dostavo do ciljnega mesta v CŽS preko KMP. Zanimiva je možnost uporabe intranazalne poti vnosa v CŽS, ki je direkten in preko katerega se izognemo zadrževanju veziklov v obtočilnem sistemu.
Eksosomi kot sistem za prenos proteinov. Če v progenitorske celice z uporabo plazmidov vnesemo zapis za izbrani protein, lahko izločeni eksosomi vsebujejo sam protein ali genetski zapis za tvorbo proteina in to prenesejo do ciljnih celic. Pomemben vidik so tudi površinsko vezani proteini, npr. antigen-predstavitvene molekule, ki omogočajo potovanje ekosomov na določeno mesto in regulacijo imunskega sistema.
Eksosomi kot sistem za prenos nukleinskih kislin. Metoda je uporabna za prenos regulatornih molekul RNA, ki jih ciljna celica lahko ponotranji. Tako molekula RNA lahko vpliva na povišano ali znižano regulacijo genov ciljne celice. Na poti do cilja jih eksosomi ščitijo pred delovanjem zunajceličnih endonukleaz 4 10 17.
Zaključek
Zunajcelični vezikli, predvsem eksosomi, kot terapevtsko orodje predstavljajo zanimivo raziskovalno področje, tudi zaradi njihove pomembne vloge v medcelični komunikaciji. Eksosomi, ki jih izločajo možganske celice, lahko pomembno vplivajo na mikrookolje in prispevajo k napredovanju bolezni ali pa delujejo daljnosežno s prenosom preko bioloških tekočin. Te njihove izjemne lastnosti nam omogočajo, da jih uporabljamo kot biološke označevalce ali kot prenašalce bioloških molekul in zdravil na ciljna mesta. Ko bomo natančno poznali mehanizme njihovega delovanja ter jih znali učinkovito izolirati in/ali modificirati, se nam bodo odprle številne možnosti uporabe, tudi prepotreben razvoj novih metod zdravljenja bolezni centralnega živčnega sistema.
-
___
-
Dong H. Current strategies for brain drug delivery. Theranostics. 2018;8:1481-1493. ↩
-
Wood MJA, O’Loughlin AJ, Samira L. Exosomes and the blood-brain barrier: implications for neurological diseases. Therapeutic Delivery. 2011;2:1095-1099. ↩
-
World Health Organization. The top 10 causes of death. World Health Organization. https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death. Objavljeno maja 2018. Datum dostopa 07.07.2020. ↩
-
Aryani A, Denecke B. Exosomes as a nanodelivery system: a key to the future of neuromedicine? Molecular neurobiology. 2016;53:818-834. ↩
-
Hersh DS, Wadajkar AS, Roberts N. Evolving drug delivery strategies to overcome the blood brain barrier. Current pharmaceutical design. 2016;22:1177-1193. ↩
-
Andras IE, Toborek M. Extracellular vesicles of the blood-brain barrier. Tissue Barriers. 2016;4:e1131804. ↩
-
Gray SJ, Woodard KT, Samulski RJ. Viral vectors and delivery strategies for CNS gene therapy. Therapeutic delivery. 2010;1:517-534. ↩
-
Saraiva C, Praca C, Ferreira R. Nanoparticle-mediated brain drug delivery. Overcoming blood-brain barrier to treat neurodegenerative diseases. Journal of controlled release. 2016;235: 34-47. ↩
-
Rufino-Ramos D, Albuquerque PR, Carmona V. Extracellular vesicles: novel promising delivery systems for therapy of brain diseases. Journal of controlled release. 2017;262:247-258. ↩
-
Thery C, Zitvogel L, Amigorena S. Exosomes: composition, biogenesis and function. Nature reviews immunology. 2002;2:569-579. ↩
-
Barile L, Vassalli G. Exosomes: therapy delivery tools and biomarkers of disease. Pharmacology and therapeutics. 2017;174:63-78. ↩
-
Sun D, Zhuang X, Zhang S. Exosomes are endogenous nanoparticles that can deliver biological information between cells. Advanced drug delivery reviews. 2013;65:342-347. ↩
-
Rajendran L, Honsho M, Zahn TR. Alzheimer’s disease β-amyloid peptides are released in association with exosomes. Proceedings of the national academy of sciences. 2006;103:11172-11177. ↩
-
Alvarez-Erviti L, Seow Y, Yin H. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes. Nature Biotechnology. 2011;29:341-345. ↩
-
Zhuang X, Xiang X, Grizzle W. Treatment of brain inflammatory diseases by delivering exosome encapsulated anti-inflammatory drugs from the nasal region to the brain. Molecular therapy, the journal of the american society for gene therapy. 2011;19:1769-1779. ↩
-
Cooper MJ, Wilander OPB, Nordin JZ. Systemic exosomal siRNA delivery reduced alpha-synuclein aggregates in brains of transgenic mice. Movement disorders. 2014;29:1476-1485. ↩
-
Ha D, Yang N, Nadithe V. Exosomes as therapeutic drug carriers and delivery vehicles across biological membranes: current perspectives and future challenges. Acta Pharmaceutica Sinica B. 2016;6:287-296. ↩
dr. Saša Koprivec, univ. dipl. bioteh.
Laboratorij za genomiko
Inštitut za predklinične vede
Veterinarska fakulteta UL