Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Vloga magnetnoresonančne spektroskopije pri obravnavi možganskih tumorjev
članki
eSinapsa, 2011-1
Zvezdan Pirtošek
Eksoskeleti – inteligentne bionske naprave
Marko Munih
O aktualnih dilemah draženja globokih možganskih struktur pri obsesivno - kompulzivni motnji
Nadja Jarc
Sledite svojo srečo ... z iPhone
Urban Kordeš
eSinapsa, 2011-2
Renata Salecl
Gašper Tkačik
Astrociti – spregledane zvezde nevrobiologije
Marko Kreft, Robert Zorec
Sašo Dolenc
Meditacija - malo truda, veliko koristi
Luka Dimic
eSinapsa, 2011-3
Mara Bresjanac
Martina Starc
Rok Berlot
Varnost uporabe generičnih protiepileptičnih zdravil
Mojca Kržan, Matevž Kržan
Možgani, računalniki - nekaj vmes
Miha Pelko
eSinapsa, 2012-4
Ali so moški in ženski možgani različni?
Gregor Majdič
O kognitivnih motnjah pri bolnikih s Parkinsonovo boleznijo
Dejan Georgiev
Akutno možgansko kap lahko uspešno zdravimo
Nina Vujasinovič, Bojana Žvan
Vloga nevropsihološke diagnostike pri odkrivanju zgodnjih znakov alzheimerjeve bolezni
Simon Brezovar
eSinapsa, 2013-5
Srečanje dveh velikanov: možganov in imunskega sistema
Matej Markota
Novo odkritje na področju sporadičnih prionskih bolezni
Jana Jerše, Nadja Jarc
Učinek placeba brez lažnih zdravil in zavajanja
Mara Bresjanac
Subarahnoidna krvavitev zaradi tromboze venskih sinusov
Mateja Repar, Anita Resman Gašperčič
eSinapsa, 2013-6
Odstranjevanje možganskih tumorjev pri budnem bolniku
Andrej Vranič, Jasmina Markovič, Blaž Koritnik
Zmedena bolnica, ki nič ne vidi ali PRES
Manja Hribar, Vid Zgonc
Manja Hribar
Netravmatska lokalizirana konveksitetna subarahnoidna krvavitev
Mateja Repar, Fajko F. Bajrović
Sistemska skleroza in ishemična možganska kap - vzročna povezanost ali le koincidenca?
Mateja Repar, Janja Pretnar Oblak
Klemen Grabljevec
Z omejevanjem spodbujajoča terapija pri bolnikih po nezgodni možganski poškodbi
Dejana Zajc, Klemen Grabljevec
eSinapsa, 2014-7
Možgani v mreži navezanosti, ki nas zaznamuje
Barbara Horvat
Vpliv senzoričnega dotoka na uglasitev možganskih povezav
Peter Gradišnik
Človeški konektom ali kakšne so zveze v naših možganih
Blaž Koritnik
Niko Lah
Torkove delavnice za osnovnošolce
Mateja Drolec Novak, Vid V. Vodušek
Da ne pozabim! Tehnike za pomladitev spomina
Klara Tostovršnik, Hana Hawlina
Površina socialne nevroznanosti
Manuel Kuran
Clarity - bistri možgani Karla Deisserotha
Gregor Belušič
Barbara Gnidovec Stražišar
Bojana Žvan
Nevroplastičnost po možganski kapi
Marjan Zaletel
Klinično psihološka obravnava pacientov po možganski kapi in podpora pri vračanju na delovno mesto
Barbara Starovasnik Žagavec
Možgani: organ, s katerim ljubimo
Andraž Matkovič
Marija Šoštarič Podlesnik
Gibalno-kognitivna vadba: praktična delavnica
Mitja Gerževič, Marina Dobnik
Anton Grad
Nevrologija, imunologija, psihiatrija …
Bojan Rojc
Andraž Stožer, Janez Bregant
Dominika Novak Pihler
Možganska kap – »kako ostati v omrežju?«
Nina Ozimic
Klara Tostovršnik
eSinapsa, 2014-8
Znotrajžilno zdravljenje možganskih anevrizem
Tamara Gorjanc, Dimitrij Lovrič
Obravnava hladnih možganskih anevrizem
Bojana Žvan, Janja Pretnar Oblak
Ali deklice z Rettovim sindromom govorijo z očmi?
Anka Slana, Urška Slana
Progresivna multifokalna encefalopatija
Urša Zabret, Katarina Šurlan Popovič
Ne ubijaj – poskusi na živalih
Martina Perše
Poizkusi na živalih - za in proti
Simon Horvat
eSinapsa, 2015-9
Kako deluje navigacijski sistem v naših možganih
Simon Brezovar
Vsakodnevno delo slepe osebe / s slepo osebo
Denis Kamnar
Uroš Marušič
Manca Tekavčič Pompe
Toni Pustovrh
Marko Hawlina
Od svetlobe do podobe ali kako vidijo svet naši možgani
Simon Brezovar
Janja Hrastovšek
Zala Kurinčič
Pogledi na mejno osebnostno motnjo
Jerica Radež, Peter Kapš
Uvid kot socialno psihološki fenomen
Vid Vodušek
Uvod v vidno-prostorske funkcije s praktičnimi primeri
Ana Bujišić, Sanja Roškar
eSinapsa, 2015-10
Difuzijsko magnetnoresonančno slikanje
Rok Berlot
Katja Pavšič
Radiološko izolirani sindrom - ali ga moramo poznati?
Matej Vouk, Katarina Šurlan Popovič
Kako izgledajo možgani, ki govorijo več jezikov?
Gašper Zupan
Nov pristop v rehabilitaciji - terapija s pomočjo psa
Mateja Drljepan
Pogled v maternico z magnetnoresonančno preiskavo
Taja Jordan, Tina Vipotnik Vesnaver
Saša Zorjan
Saša Zorjan
Nevroestetika: ko nevroznanost obišče galerijo
Anja Voljavec, Hana Hawlina, Nika Vrabič
Ali so psihogeni neepileptični napadi res psihogeni?
Saška Vipotnik, Gal Granda
Kako nam lahko glasna glasba »vzame« sluh in povzroči tinitus
Nejc Steiner, Saba Battelino
eSinapsa, 2016-11
Mara Bresjanac
Kako ultrazvok odpira pot v možgane
Kaja Kolmančič
Kako je epigenetika spremenila nevroznanost
Metka Ravnik Glavač
Ondinino prekletstvo ali sindrom prirojene centralne hipoventilacije
Katja Pavšič, Barbara Gnidovec Stražišar, Janja Pretnar Oblak, Fajko F. Bajrović
Zika virus in magnetnoresonančna diagnostika nepravilnosti osrednjega živčevja pri plodu
Rok Banko, Tina Vipotnik Vesnaver
Motnje ravnotežja otrok in odraslih
Nejc Steiner, Saba Battelino
eSinapsa, 2016-12
Vloga magnetnoresonančne spektroskopije pri obravnavi možganskih tumorjev
Gašper Zupan, Katarina Šurlan Popovič
Tiskanje tridimenzionalnih modelov v medicini
Andrej Vovk
Aleš Oblak
Kevin Klarič
Sinestezija: umetnica, ki ne želi odrasti
Tisa Frelih
Računska psihiatrija: od nevroznanosti do klinike
Nastja Tomat
Kognitivni nadzor: od vsakdanjega življenja do bolezni
Vida Ana Politakis
eSinapsa, 2017-13
Internet: nadgradnja ali nadomestek uma?
Matej Perovnik
Vloga črevesnega mikrobioma pri odzivu na stres
Vesna van Midden
Stres pušča posledice tako na človeškem kot živalskem organizmu
Jasmina Kerčmar
Prikaz normalne anatomije in bolezenskih stanj obraznega živca z magnetno resonanco
Rok Banko, Matej Vrabec
Psihedelična izkušnja in njen zdravilni potencial
Anja Cehnar, Jona Basle
Vpliv hiperglikemije na delovanje možganov
Jasna Šuput Omladič, Simona Klemenčič
Nevrofibromatoza: napredujoče obolenje centralnega in perifernega živčevja
Nejc Steiner, Saba Battelino
Fenomen žrtvenega jagnja v dobi interneta
Dolores Trol
Tesnoba staršev in strategije spoprijemanja, ko pri otroku na novo odkrijejo epilepsijo
Daša Kocjančič, Petra Lešnik Musek, Vesna Krkoč, David Gosar
eSinapsa, 2017-14
Zakaj ne zapeljem s ceste, ko kihnem?
Anka Slana Ozimič, Grega Repovš
Nobelova nagrada za odkritje molekularnih mehanizmov nadzora cirkadianih ritmov
Leja Dolenc Grošelj
Možgani pod stresom: od celic do duševnih motenj
Nastja Tomat
Na sledi prvi vzročni terapiji Huntingtonove bolezni
Danaja Metul
Razlike med spoloma pri Parkinsonovi bolezni
Kaja Kolmančič
eSinapsa, 2018-15
Susceptibilno poudarjeno magnetnoresonančno slikanje pri bolniku z ALS
Alja Vičič, Jernej Avsenik, Rok Berlot
Sara Fabjan
Reverzibilni cerebralni vazokonstrikcijski sindrom – pot do diagnoze
Maja Cimperšek, Katarina Šurlan Popovič
Liam Korošec Hudnik
Kognitivno funkcioniranje pri izgorelosti
Marina Horvat
eSinapsa, 2019-16
Maša Čater
Saša Koprivec
Infekcije osrednjega živčnega sistema s flavivirusi
Maja Potokar
Raziskava: Kako depresija vpliva na kognitivne sposobnosti?
Vida Ana Politakis
Razvoj depresije pri otrocih z vidika navezovalnega vedenja
Neža Grgurevič
Sonja Prpar Mihevc
Umetno inteligentna nevroznanost: srečanje nevronskih mrež in možganske fiziologije
Kristijan Armeni
Čebelji strup pri preventivi nevrodegenerativnih bolezni in priložnost za klinično prakso
Matjaž Deželak
eSinapsa, 2019-17
IgG4+ – skupni imenovalec diagnoz iz preteklosti
Cene Jerele, Katarina Šurlan Popovič
Nov molekulski mehanizem delovanja ketamina v astrocitih
Matjaž Stenovec
Praktični pristop k obravnavi utrujenosti in motenj spanja pri bolnikih z multiplo sklerozo
Nik Krajnc, Leja Dolenc Grošelj
Jure Pešak
eSinapsa, 2020-18
Bolezni spektra anti-MOG pri odraslih
Nik Krajnc
Samomor pod lupo nevroznanosti
Alina Holnthaner
eSinapsa, 2020-19
Ob mednarodnem dnevu znakovnih jezikov
Anka Slana Ozimič
Teorija obetov: kako sprejemamo tvegane odločitve
Nastja Tomat
Sara Fabjan
Matjaž Deželak
Nina Stanojević, Uroš Kovačič
Od človeških nevronov do možganskih organoidov – nova obzorja v nevroznanosti
Vesna M. van Midden
Splošna umetna inteligenca ali statistične jezikovne papige?
Kristijan Armeni
Zunajcelični vezikli kot prenašalci zdravilnih učinkovin preko krvno-možganske prepreke
Saša Koprivec
Matjaž Deželak
eSinapsa, 2021-20
Migrena: starodavna bolezen, sodobni pristopi k zdravljenju
Eva Koban, Lina Savšek
Zgodnji razvoj socialnega vedenja
Vesna Jug
Nastja Tomat
Mikrosplet: povezovanje preko mikrobioma
Tina Tinkara Peternelj
Stimulacija možganov kot način zdravljenja depresije
Saša Kocijančič Azzaoui
eSinapsa, 2021-21
eSinapsa, 2022-22
Sodobni vidiki motenj hranjenja
Karin Sernec
Ples in gibalni dialog z malčki
Neva Kralj
Atul Gawande
Jezikovna funkcija pri Alzheimerjevi bolezni
Gašper Tonin
Dostava terapevtikov preko krvno-možganske pregrade
Matjaž Deželak
eSinapsa, 2022-23
Akutni ishemični infarkt hrbtenjače pri zdravih otrocih – kaj lahko pove radiolog?
Katarina Šurlan Popovič, Barbara Šijaković
eSinapsa, 2023-24
Možganska omrežja pri nevrodegenerativnih boleznih
Tomaž Rus, Matej Perovnik
Morske živali kot navdih za nevroznanstvenike: morski konjiček, morski zajček in klobučnjak
Tina Bregant
Metoda Feldenkrais: gibanje in nevroplastičnost
Mateja Pate
Etično naravnana animalna nevroznanost
Maša Čater
Helena Motaln, Boris Rogelj
eSinapsa, 2023-25
Urban Košak, Damijan Knez, Anže Meden, Simon Žakelj, Jurij Trontelj, Jure Stojan, Maja Zakošek Pipan, Kinga Sałat idr.
eSinapsa, 2024-26
Naravno okolje kot vir zdravja in blagostanja
Karin Križman, Grega Repovš, Gaja Zager Kocjan, Gregor Geršak
Katja Peganc Nunčič, Damjan Osredkar
Nuklearna magnetnoresonančna spektroskopija (MRS) je bila razvita leta 1946 1, leta 1995 pa je Zvezni urad za hrano in zdravila v ZDA odobril avtomatiziran protokol MRS za klinično rabo 2. Danes je MRS sestavni del številnih magnetnoresonančnih (MR) protokolov in omogoča neinvazivno ter relativno hitro kemijsko analizo človeških tkiv.


V medicini se najpogosteje uporablja vodikova protonska MRS (v nadaljevanju MRS). Obstajajo tudi druge (npr. ogljikova ali fluorova), ki pa so dolgotrajne, potrebujejo dodatno opremo in se izvajajo le v redkih raziskovalnih centrih 3, zato jih v tem prispevku ne bomo podrobneje omenjali. Morfološko MR slikanje temelji na zaznavi signala vodikovih protonov iz vode, ki so različno razporejeni v tkivih. MRS prav tako zaznava signale vodikovih protonov, vendar ne iz vode, ampak iz drugih molekul, kot so npr. lipidi in aminokisline, ki vsebujejo vodikove protone 4. Morfološko MR slikanje se osredotoča na zaznavo enega vrha (molekule vode), končni produkt pa predstavlja slika porazdelitve vode po različnih tkivih. MRS zaznava skupek vrhov, ki predstavljajo vodikov atom v različnih kemičnih okoljih. Končni produkt tako ni porazdelitev vode po tkivih, ampak krivulja – spekter3. Slika 1A prikazuje rezultat morfološkega MR slikanja možganov, Slika 1B pa spekter, ki ga dobimo, če uporabimo MRS.
Pri različnih jakostih magnetnega polja ima proton vodika različne resonančne frekvence. Pri moči magnetnega polja 1,5 tesla (T) resonančna frekvenca znaša okoli 64 MHz. Ko zajemamo spekter, zaznamo frekvenčne premike (ang. frequency shifts), ki ponazarjajo kemično raznolikost tkiva, ki ga preučujemo. Ker so frekvenčni premiki zelo majhni, se je razvila enota delcev na milijon (ppm), ki predstavlja enoto na x-osi spektra, medtem ko lahko na y-osi odčitamo amplitudo posameznega vrha 5. Frekvenčni premik se v praksi imenuje kemijski premik (ang. chemical shift), saj je odvisen od kemijske zgradbe opazovanega metabolita 3. Spekter lahko zanesljivo opazujemo le v majhnem geometrijskem prostoru (najboljša je oblika kocke 3), ki ga imenujemo voksel. Moderni MR tomografi omogočajo sočasno zaznavo spektrov v več vokslih (t. i. tehnika multivoksel) 6. MRS je neinvazivna metoda2 in preiskovanca ne izpostavlja radioaktivnemu sevanju4. Spekter zdrave možganovine posnet na MR tomografu z močjo magnetnega polja 3T Phlips Achieva iz Centra za klinično fiziologijo Medicinske fakultete v Ljubljani je prikazan na Sliki 1B.
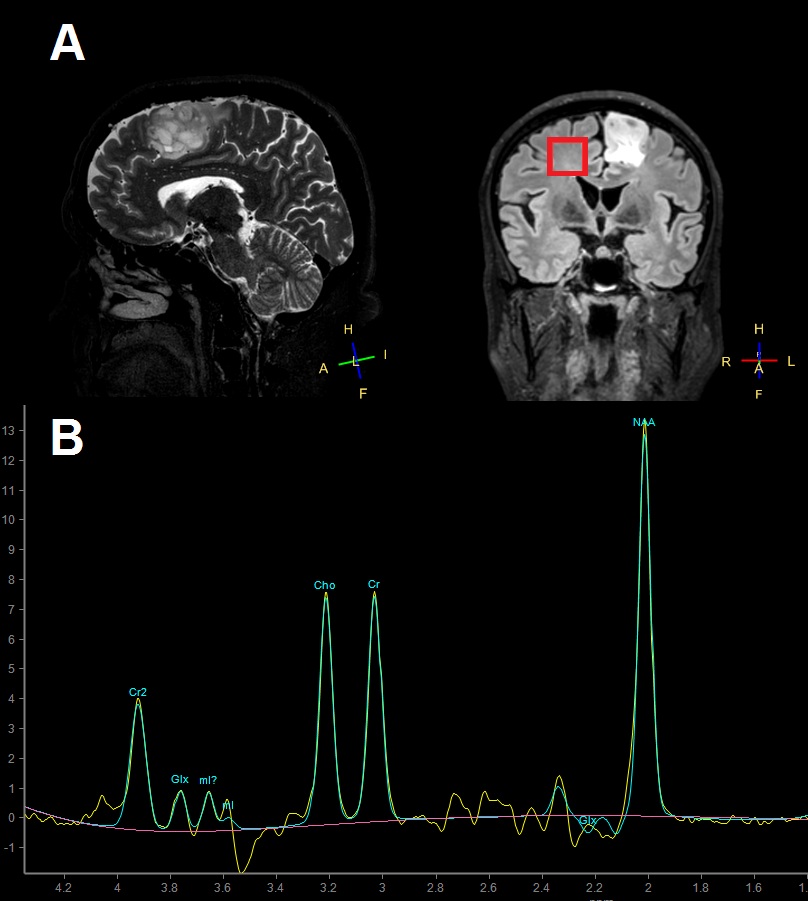
Slika 1A: Morfološka MR slika pacienta z možganskim tumorjem, prikazani sta sagitalna in koronarna ravnina. MRS se izvede le v prostoru, ki ga natančno zamejimo. Ta prostor imenujemo voksel in je na sliki prikazan z rdečim kvadratkom. 1B: MR spekter zdrave možganovine v vokslu, ki je označen z rdečim kvadratkom. Cho – holin, NAA - N-acetil aspartat, Cr – kreatin, Glx – skupen vrh glutamata in glutamina, mI – mioinozitol.
Standardna MRS obravnava
MRS predstavlja pomembno funkcionalno diagnostično orodje, ki v povezavi z drugimi diagnostičnimi metodami z večjo gotovostjo postavi diagnozo 1. Z MRS lahko v živem organizmu opazujemo majhne, mobilne molekule s koncentracijo nad 0,5 mikromol/g. Tako z metodo MRS ni mogoče prikazati večine nevrotransmiterjev (izjeme so naštete v nadaljevanju) in nekaterih nemobilnih makromolekul, kot sta tudi DNK in RNK 3. Od moči magnetnega polja in parametra TE (ang. echo time) je odvisno, katere metabolite bomo lahko zaznali. Pri jakosti magnetnega polja 1,5 T in pri dolgem TE (144–288 ms) bomo dobro prikazali N-acetil aspartat (NAA), holin, kreatin, alanin in laktat. Pri isti jakosti in kratkem TE (pod 40 ms) bodo dobro vidni mioinozitol, glukoza in nekateri proteini ter lipidi 2. Prikažemo lahko tudi nevrotransmiterja glutamat in glutamin (skupna oznaka Glx) 2, s posebnim metodami urejanja spektra (ang. spectral editing) pa tudi nevrotrasmiter GABA ter antioksidant glutation 6. Sodobni MR tomografi, namenjeni vsakodnevni klinični praksi, imajo vgrajeno programsko opremo za avtomatsko analizo osnovnega spektra. V Centru za klinično fiziologijo preiskave opravljamo na napravi Philips Achieva z močjo magnetnega polja 3T. Na Sliki 1B so s kraticami označeni tudi vrhovi posameznih komponent spektra, analiziranih s pomočjo programa Spectroview.
Osnovne spremembe spektra pri možganskem tumorju so povečan holin, laktat in lipidi ter zmanjšanje NAA in kreatina 2. V možganovini lahko z MRS zaznamo okoli 30 različnih metabolitov 6, vendar pa se v vsakodnevni klinični praksi osredotočamo le na nekatere. Pri možganskih tumorjih, ki izrastejo iz podpornih celic (gliomov) in so zelo maligni, v večini primerov zaznamo večje koncentracije holina kot pri manj malignih oblikah. Vendar moramo paziti, kam postavimo voksel. V področjih velikih nekroz, ki so značilne za najbolj maligne oblike gliomov, lahko dobimo tudi spekter z nizko koncentracijo holina. Relativno zanesljiv in najpogosteje preučevan pokazatelj malignosti pri gliomih je razmerje med NAA in holinom. Študije so pokazale, da pri bolj malignih oblikah gliomov zaznamo povečane vrednosti lipidov, laktata in mioinozitola. Ob vsem tem se je treba zavedati, da je MRS visoko senzitivna in nizko specifična metoda 2, kar pomeni, da dobro prepoznava nenormalne spremembe metabolitov, vendar te spremembe ne moremo pripisati točno določenemu vzroku. Slika 2 prikazuje spekter možganskega tumorja z nizko malignostjo, ki je bil posnet v Centru za klinično fiziologijo Medicinske fakultete v Ljubljani in avtomatsko analiziran s programom Spectroview.
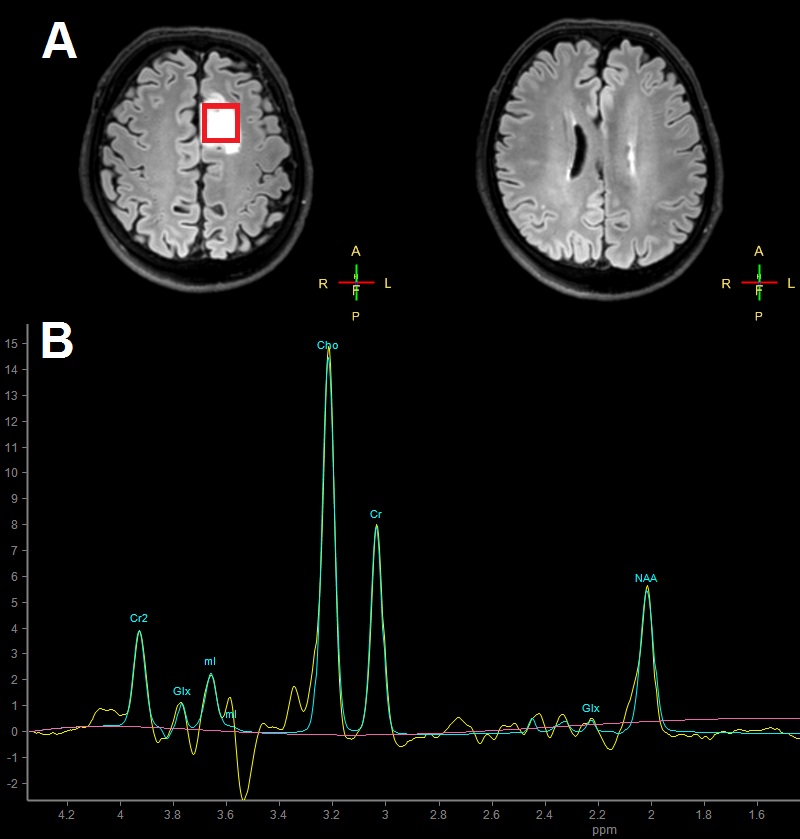
Slika 2A: MR slika istega preiskovanca kot iz Slike 1. Tokrat je prikazana transverzalna ravnina. Rdeči kvadratek ponazarja voksel, ki je v tem primeru postavljen v tumorsko tkivo. 1B: Spekter tumorskega tkiva, najverjetneje gre za nizkomaligni gliom. Cho – holin, NAA - N-acetil aspartat, Cr – kreatin, Glx – skupen vrh glutamata in glutamina, mI – mioinozitol.
Pomen zaznave metabolita 2-hidroksiglutarat z MRS
Metaboliti glutamat, glutamin in GABA imajo vrhove v prekrivajočih se območjih spektra, zato so dobro razločljivi le z MR tomografi z magnetnim poljem 3T in več 7. V tem območju so leta 2012 prvič opisali vrhove metabolita 2-hidroksiglutarat (2-HG) 8. 2-HG je onkometabolit, ki je posledica mutacije genov za izocitratdehidrogenazo 1 ali 2. Slednja mutacija je prisotna pri približno 70 % nizkomalignih gliomov in visokomalignih gliomov, ki so se razvili iz prej nizkomalignih oblik 9. Prisotnost mutacije je povezana z boljšim izhodom bolezni 10. Zato zaznava 2-HG z MRS predstavlja neinvazivno orodje za napoved uspešnosti zdravljenja. Študija iz 2013 je pokazala 86,4 % povezavo med spektroskopsko zaznanim 2-HG in genetsko ugotovljeno mutacijo v genu IDH1 8. Ameriška študija iz istega leta je ob optimizaciji protokola dokazala kar 100 % povezavo med spektroskopsko zaznanim 2-HG in genetsko ugotovljeno mutacijo v genu IDH1 ali IDH2. Med spektroskopsko negativnimi 2-HG ni bilo primera, kjer bi bila dokazana mutacija v omenjenih genih 11, kar pomeni, da gre za metodo s 100 % senzitivnostjo in specifičnostjo. Zaznava 2-HG z MRS je zanesljiva metoda za diagnosticiranje in prognoziranje bolnikov z gliomi. Kot kažejo dosedanje študije, je zanesljivo zaznavanje 2-HG z MRS možno z MR tomografi z močjo magnetnega polja 3T ali več 12. Prav tako je potrebna temeljita obdelava rezultatov z različnimi dodatnimi programskimi orodji, kot sta LCModel 13 ali Jmrui 14 15 (več na http://www.jmrui.eu). Pokazalo se je, da se 2-HG na MR tomografih moči 3T boljše prikaže pri daljšem TE 16. Omenjen metabolit lahko dobro prikažemo že s standardno sekvenco PRESS 11. Nekateri avtorji pa so poročali, da je prisotnost 2-HG mogoče dobro prikazati tudi z drugimi alternativnimi sekvencami, kot so na primer 2D LASER-COSY, 1D MEGA-LASER 17 in semi-LASER 18.
Zaključek
MRS je uveljavljena metoda za vsakodnevno klinično uporabo in ima največjo uporabnost v povezavi z drugimi funkcionalnimi in morfološkimi MR preiskavami 1. V prihodnosti lahko pričakujemo še pogostejšo uporabo MR tomografov z močjo 3T in več. Posledica tega bi bilo boljše razmerje med signalom in šumom pri zajemanju slik 3, kar bi povečalo kvaliteto MRS. Boljšo razmejitev posameznih metabolitov spektra lahko dosežemo tudi z metodami urejanja spektra, ki so uporabne predvsem v primeru, ko se metaboliti nahajajo v prekrivajočih se spektrih 6. MRS je funkcijska MR metoda, ki nam na hiter in neinvaziven način zazna metabolit, v nadaljnji analizi pa lahko pridobimo tudi absolutne ali relativne vrednosti določenih metabolitov v opazovanem tkivu, s tem pa MRS pomembno pripomore k postavitvi dokončne diagnoze.
-
___
-
Hollingworth W, Medina LS, Lenkinski RE, Shibata DK, Bernal B, Zurakowski D, et al. A systematic literature review of magnetic resonance spectroscopy for the characterization of brain tumors. AJNR Am J Neuroradiol. 2006; 27(7): 1404-11. ↩
-
Soares DP, Law M. Magnetic resonance spectroscopy of the brain: review of metabolites and clinical applications. Clin Radiol. 2009; 64(1): 12-21. ↩
-
Blüml S. Magnetic Resonance Spectroscopy: Basics. V: Blüm, S, Panigrahy A, urednika. MR Spectroscopy of Pediatric Brain Disorders. Springer Science+Business Media, 2013: 11-23. ↩
-
Nagel BJ, Kroenke CD. The use of magnetic resonance spectroscopy and magnetic resonance imaging in alcohol research. Alcohol Res Health. 2008; 31(3): 243-6. ↩
-
Massé K. MR Spectroscopy Real-Time Quantification of in-vivo MR Spectroscopic data. Trondheim: Norwegian University of Science and Technology; 2009. ↩
-
Zhu H, Barker PB. MR Spectroscopy and Spectroscopic Imaging of the Brain. Methods Mol Biol. 2011; 711: 203-26. ↩
-
Watanabe H, Takaya N, Mitsumori F. Absolute Quantitation of Glutamate, GABA and Glutamine using Localized 2D Constant-time COSY Spectroscopy in Vivo. Magn Reson Med Sci 2014; 13(1): 25-32. ↩
-
Elkhaled A, Jalbert LE, Phillips JJ, Yoshihara HA, Parvataneni R, Srinivasan R, et al. Magnetic resonance of 2-hydroxyglutarate in IDH1-mutated low-grade gliomas. Sci Transl Med 2012; 4: 116ra115. ↩
-
Ward PS, Patel J, Wise DR, Abdel-Wahab O, Bennett BD, Coller HA, et al. The common feature of leukemia-associated IDH1 and IDH2 mutations is a neomorphic enzyme activity converting alpha-ketoglutarate to 2-hydroxyglutarate. Cancer Cell. 2010 16; 17(3): 225-34. ↩
-
Sun H, Yin L, Li S, Han S, Song G, Liu N, et al. Prognostic significance of IDH mutation in adult low-grade gliomas: a meta-analysis. J Neurooncol 2013; 113: 277–284. ↩
-
Choi C, Ganji SK, DeBerardinis RJ, Hatanpaa KJ, Rakheja D, Kovacs Z, et al: 2-hydroxyglutarate detection by magnetic resonance spectroscopy in IDH-mutated patients with gliomas. Nat Med 2012; 18: 624–629. ↩
-
Kim H, Kim S, Lee HH, Heo H. In-Vivo Proton Magnetic Resonance Spectroscopy of 2-Hydroxyglutarate in Isocitrate Dehydrogenase-Mutated Gliomas: A Technical Review for Neuroradiologists. Korean J Radiol. 2016; 17(5): 620–632. ↩
-
Provencher SW. Estimation of metabolite concentrations from localized in vivo proton NMR spectra. Magn Reson Med. 1993; 30(6): 672-9. ↩
-
Naressi A, Couturier C, Devos JM, Janssen M, Mangeat C, de Beer R, Graveron-Demilly D. Java-based graphical user interface for the MRUI quantitation package. MAGMA. 2001; 12(2-3): 141-52. ↩
-
Stefan D, Cesare FD, Andrasescu A, Popa E, Lazariev A, Vescovo E, et al. Quantitation of magnetic resonance spectroscopy signals: the jMRUI software package. Measurement Science and Technology 2009; 20(10): 104035. ↩
-
Choi C, Ganji S, Hulsey K, Madan A, Kovacs Z, Dimitrov I, et al. A comparative study of short- and long-TE ¹H MRS at 3 T for in vivo detection of 2-hydroxyglutarate in brain tumors. NMR Biomed. 2013; 26(10): 1242-50. ↩
-
Andronesi OC, Kim GS, Gerstner E, Batchelor T, Tzika AA, Fantin VR, et al. Detection of 2-hydroxyglutarate in IDH-mutated glioma patients by in vivo spectral-editing and 2D correlation magnetic resonance spectroscopy. Sci Transl Med. 2012; 4(116): 116ra4. ↩
-
Berrington A, Voets NL, Plaha P, Larkin SJ, Mccullagh J, Stacey R, et al. Improved localisation for 2-hydroxyglutarate detection at 3T using long-TE semi-LASER. Tomography. 2016; 2(2): 94-105. ↩
Gašper Zupan, dr. med.
Medicinska fakulteta
Univerza v Ljubljani
doc. dr. Katarina Šurlan Popovič, dr. med., spec. radiologije
Klinični inštitut za radiologijo
Univerzitetni klinični center Ljubljana
Recenziral:
prof. dr. Dušan Šuput, dr. med.
Medicinska fakulteta
Univerza v Ljubljani
Prispelo: 14. november 2016
Sprejeto: 19. december 2016
Objavljeno: 29. januar 2017